时间:

目的:建立流通池测定曲安奈德益康唑乳膏两个活性成分的释放度方法。
方法:采用流通池法闭合系统装置测定曲安奈德益康唑乳膏的释放度,分别考察释放介质、放置方式、流速及半透膜孔径对两个活性成分体外释放曲线的影响,比较两个生产企业市售产品体外释放行为的差异;以HPLC测定释放量,采用Luna C8柱(250 mm×4.6 mm,5 μm),梯度洗脱,检测波长227 nm,柱温40℃,流速1.0 mL/min,进样量100 μL。
结果:以含0.05%十二烷基硫酸钠的0.9%氯化钠溶液为释放介质,温度为(32±0.5)℃,流速为16 mL/min,半固体适配器半透膜孔径为2.7 μm,过滤装置为0.45 μm混合纤维素膜,可以获得既能有效释放又具有一定区分力的释放曲线。曲安奈德在浓度0.0052~0.7803 μg/mL范围内线性良好(r=0.9994),硝酸益康唑在浓度0.0552~8.2851 μg/mL范围内线性良好(r=0.9993)。两个生产企业的体外释放曲线存在显著性差异,活性成分粒度可能是影响释放行为差异的主要因素之一。

药品审评中心(CDE)于2021年3月发布了《皮肤外用化学仿制药研究技术指导原则(试行)》,指出对于处方组成复杂的软膏剂、乳膏剂及凝胶剂等半固体制剂,由于具有多相、热力学不稳定等特点,体外释放的程度和速度将影响制剂质量与性能差异,应开展体外释放试验,但国内体外释放试验条件及操作方法仍缺乏明确的指导原则,其中指出建议参考国内、外相关文献与指导原则开展相关研究工作。美国药典2021版通则<1724>提供了半固体制剂体外释放测定装置,包括垂直扩散池(vertical diffusion cell, VDC)和流通池法(flow-through cell)。Chattaraj等早在1996年提出流通池法可用于半固体制剂体外释放度研究,与垂直扩散池比较,流通池法更具有区分力且可以避免气泡对测定结果的影响。流通池法早已经被国外多国药典收载,《中国药典》2020年四部新增第六法流池法,国内最近有文献报道流通池法为贴剂、半固体制剂等特殊制剂的体外释放度控制提供一种新的评价方法,但目前应用不多且方法不成熟。
曲安奈德益康唑乳膏是由Janssen公司开发的复方乳膏剂,规格为每克含硝酸益康唑10 mg与曲安奈德1mg,上市国家为英国、法国,商品名Pevaryl®/Pevisone®,原研未进口销售,国内有16家生产企业。前期研究结果表明,地产化产品(商品名:派瑞松®)、国内仿制代表产品(商品名:邦力®)与原研产品的处方组成(Q1)、处方用量(Q2)、微观结构特性(Q3)均存在较大差异。李震等采用垂直扩散池研究了不同厂家曲安奈德益康唑乳膏的体外透皮吸收试验,但流通池法测定本品体外释放度暂无报道研究。本文旨在建立流通池法测定体外释放度方法,从而研究Q3对体外释放行为差异的影响,以用于指导本品一致性评价研究,为豁免生物等效性研究提供研究依据。
2.1试验仪器
流通池(推荐使用华溶DS-7CP流池法溶出系统);Thermo UltiMate 3000高效液相色谱仪(美国赛默飞公司);XP 205十 万分之一电子天平(梅特勒-托利多公司)。
2.2药品与试剂
曲安奈德益康唑乳膏(商品名派瑞松®,批号JKJOD80)购自A厂;曲安奈德益康唑乳膏(商品名邦力®,批号2019010)购自B厂;曲安奈德对照品(批号100055-201804)、硝酸益康唑对照品(批号100214-202005)购自中国食品药品检定研究院,质量分数均>98%;己烷磺酸钠购自百塞勤化学技术有限公司;磷酸、四氢呋喃和四丁基氢氧化铵购自成都市科隆化学品有限公司;色谱级乙腈、异丙醇和甲醇购自安徽时联特种溶剂股份有限公司。
3.1.1 色谱条件
辛烷基硅烷键合硅胶为填充剂(Luna C8,250 mm ×4.6 mm,5 μm),以取己烷磺酸钠0.94 g,加乙腈-异丙醇-水-85%磷酸(140:140:720:1)溶解并稀释至1000 mL为流动相A,以取己烷磺酸钠0.94 g,加甲醇-水-85%磷酸(900:100:1)溶解并稀释至1000 mL为流动相B,按表1梯度洗脱;检测波长227 nm;柱温40℃;流速1.0 mL/min;进样量100 μL。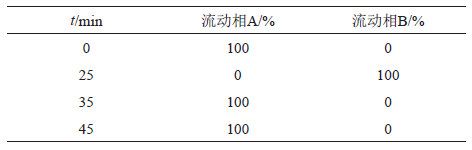
3.1.2 释放条件
照溶出度与释放度测定法(《中国药典》2020年版四部通则0931第六法)测定。采用流通池法闭合系统装置(释放度试验用流通池见图1),取本品约0.1 g,均匀涂抹于孔径为2.7 μm的半透膜,并置于半固体适配器(规格1.2 mL),放入内径为22.6 mm的标准片剂池(半透膜朝下),以200 mL含0.05%十二烷基硫酸钠的0.9%氯化钠溶液为释放介质,温度为(32±0.5)℃,流速为16 mL/min,脉冲为120,经0、2、4、8、12、18、24和30 h取样1.5 mL。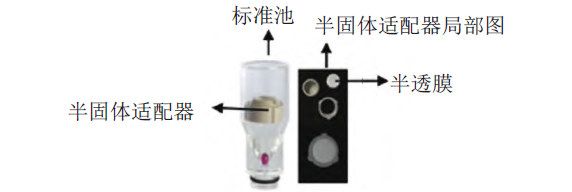
3.1.3 溶液的配制
取“3.1.2”项下释放溶液作为供试品溶液。精密称取曲安奈德对照品约10mg,置10mL量瓶中,用甲醇溶解并稀释至刻度,作为曲安奈德对照品贮备溶液;另取硝酸益康唑对照品约10mg,置20mL量瓶中,精密加入曲安奈德对照品贮备溶液1mL,用甲醇溶解并稀释至刻度,摇匀;精密量取1mL,置100mL量瓶中,用释放介质稀释至刻度,摇匀,作为对照品溶液。
3.2 体外释放度方法学验证
3.2.1 专属性试验
取本品约0.1 g,照“2.1.2”项下操作,经30 h取样1.5 mL,作为供试品溶液。另取曲安奈德对照品与硝酸益康唑对照品各适量,照“2.1.3”项下配制对照品溶液。取上述溶液,按“2.1.1”项下色谱条件测定,记录色谱(图2)。结果表明,在本色谱条件下,曲安奈德、硝酸益康唑与相邻色谱峰分离良好,溶剂峰不干扰测定。
3.2.2 精密度试验
取对照品溶液100 μL,按“2.1.1”项下色谱条件连续进样6针,记录色谱图,计算2个主成分峰面积相对标准偏差,结果曲安奈德与硝酸益康唑峰面积RSD分别为0.5%和0.2%,精密度良好。
3.2.3 线性关系考察
取曲安奈德与硝酸益康唑对照品各适量,用甲醇适量使溶解,加释放介质稀释制成系列对照品溶液,按“2.1.1”项下色谱条件测定,记录色谱图。以浓度(C)为横坐标,峰面积(A)为纵坐标绘制标准曲线,计算回归方程及相关系数。结果表明:曲安奈德在浓度0.0052~0.7803 μg/mL范围内线性良好,回归方程A=2.3944C+0.0167,相关系数0.9994;硝酸益康唑在浓度0.0552~8.2851 μg/mL范围内线性良好,回归方程A=4.1645C+0.1606,相关系数0.9993。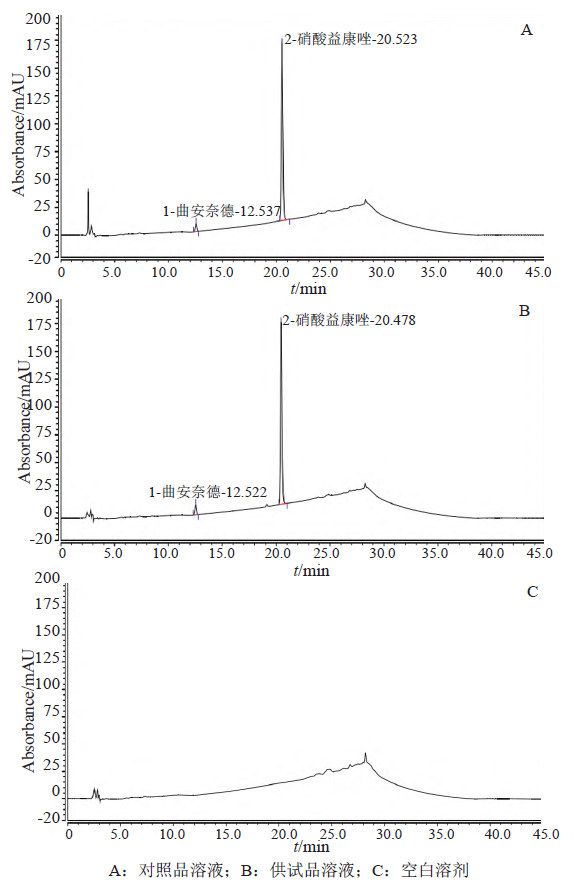
3.2.4 回收率试验
取本品约0.05g,精密称定,置200mL量瓶中,平行9份。另取对照品各适量,精密称定,用适量甲醇溶解后,用释放介质定量稀释制成每1 mL中约含曲安奈德10 μg和硝酸益康唑100 μg的混合溶液,作为对照品贮备溶液。精密量取对照品贮备溶液4、5和7 mL各3份,分别置上述9个量瓶中,用释放介质稀释至刻度,摇匀,用0.45 μm滤膜滤过,取续滤液分别作为80%、100%和140%回收供试品溶液。取本品约0.1 g,置200 mL量瓶中,加甲醇适量超声使溶解,用释放介质稀释至刻度,摇匀,用0.45 μm滤膜滤过,取续滤液作为供试品溶液。按“2.1.1”项下色谱条件测定,记录色谱图,并计算回收率。结果表明,曲安奈德和硝酸益康唑平均回收率分别为99.7%和99.8%,RSD分别为1.4%和1.1%(n=9)。
3.2.5 溶液稳定性
取本品约0.1 g,照“2.1.2”项下操作,经30 h取样1.5 mL,作为供试品溶液。按“2.1.1”项下色谱条件测定,分别于0、8、12、24和72 h注入液相色谱仪,记录色谱图。计算两个主成分峰面积相对标准偏差,结果表明,曲安奈德与硝酸益康唑峰面积RSD分别为0.3%和0.5%,说明在72 h内溶液稳定性良好。
3.2.6 溶液稳定性
取“2.2.3”项下溶液,逐级稀释后注入液相色谱仪,依法测定,记录色谱图。以信噪比S/N=3:1计算检测限,以信噪比为S/N=10:1计算定量限。检测限为:曲安奈德 0.94 ng/mL、硝酸益康唑0.45 ng/mL;定量限为:曲安奈德 3.15 ng/mL、硝酸益康唑1.50 ng/mL。
3.3 释放度测定条件的确定
3.3.1 释放介质的选择
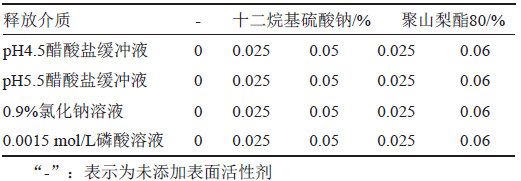
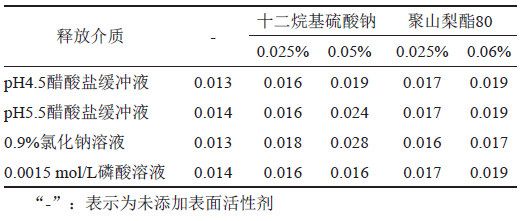
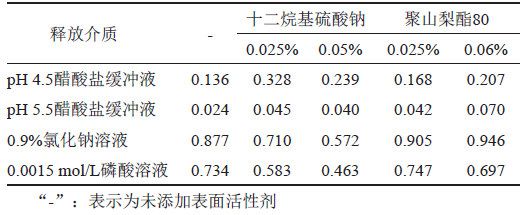
本品的给药方式为皮肤局部用药,皮肤的pH值大约在5.0左右,呈弱酸性,故本研究选择pH 4.5醋酸盐缓冲液、pH 5.5醋酸盐缓冲液、0.0015 mol/L磷酸溶液及0.9%氯化钠溶液共4种溶液,考察曲安奈德与硝酸益康唑在不含表面活性剂、含表面活性剂的释放介质中的溶解度。取曲安奈德约10 mg和硝酸益康唑约20 mg,精密称定,分别加入10 mL释放介质(表2),温度为25℃,以200 r/min持续搅拌24 h,取出,冷却至室温,离心,取上清液,按“2.1.1”项下色谱条件测定,记录色谱图,并计算溶解度。本品的规格为每1 g中含曲安奈德1 mg与硝酸益康唑10 mg,结果表明(表3~4),曲安奈德在含0.05%十二烷基硫酸钠的0.9%氯化钠溶液中溶解度最高;硝酸益康唑在0.9%氯化钠溶液中的饱和溶解度明显高于另3种介质。根据本品用法用量,每日早晚各给药1次,结合前期不同给药剂量的释放曲线研究结果, 两种活性成分释放时间太长,不利于缩短评价时间,综上所述,初步选择含0.05%十二烷基硫酸钠的0.9%氯化钠溶液作为释放介质。
3.3.2 放置方式的选择
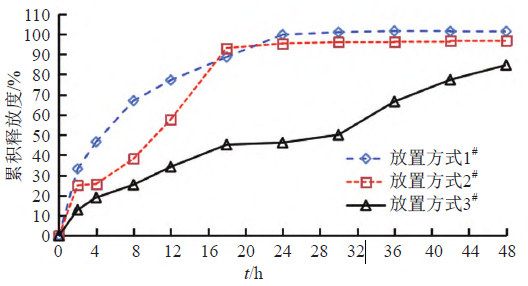
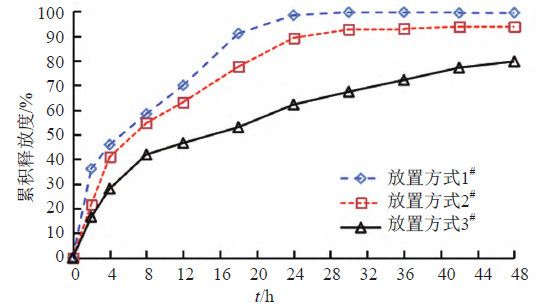
照溶出度与释放度测定法(《中国药典》2020年版四部通则0931第六法)测定。采用流通池法闭合系统装置,取本品约0.1 g,载样方式见表5,以200 mL含0.05%十二烷基硫酸钠的0.9%氯化钠溶液为释放介质,温度为(32±0.5)℃,活塞泵流速为8 mL/min,脉冲为120。分别经0、2、4、8、12、18、24、30、36、42和48 h取样1.5 mL,取溶液按“2.1.1”项下色谱条件测定,记录色谱图,计算释放量,绘制释放曲线,研究载样方式对释放度的影响,结果见图4~5。结果表明,虽然半固体适配器载样方式的释放慢于标准池直接载样,但RSD值更小,重复性更好,故初步确定半固体适配器作为释放度测定的载样方式。
3.3.3 流速的选择
照溶出度与释放度测定法(《中国药典》2020年版四部通则0931第六法)测定。采用流通池法闭合系统装置,取本品约0.1 g,均匀涂抹于玻璃纤维膜(孔径2.7 μm),并置于半固体适配器(规格1.2 mL),放入内径为22.6 mm的标准片剂池(膜朝下),以200 mL含0.05%十二烷基硫酸钠的0.9%氯化钠溶液为释放介质,温度为(32±0.5)℃,脉冲为120,分别以活塞泵流速为8、16和32 mL/min测定。经0、2、4、8、12、18、24、30、36、42和48 h取样1.5 mL,取溶液按“2.1.1”项下色谱条件测定,记录色谱图,计算释放量,绘制释放曲线,研究流速对释放度的影响,结果见图6~7。结果表明,随着流速的增加,在相同时间内药物释放量均显著性增加,当流速为8 mL/min时,在48 h内两个活性成分均不能达到释放平台;当流速为32 mL/min时释放较快,只有2个点释放度低于85%;16 mL/min有4个点释放度低于85%。为更好计算释放曲线相似因子,以评价不同产品体外释放曲线差异,因此本研究选择流速为16 mL/min,建立更具有区分力的体外释放度方法。

3.3.4 半透膜孔径的选择
照溶出度与释放度测定法(《中国药典》2020年版四部通则0931第六法)测定。采用流通池法闭合系统装置,取本品约0.1 g,分别均匀涂抹于孔径为0.7和2.7 μm半透膜,并置于半固体适配器(规格1.2 mL),放入内径为22.6 mm的标准片剂池(膜朝下),以200 mL含0.05%十二烷基硫酸钠的0.9%氯化钠溶液为释放介质,温度为(32±0.5)℃,脉冲为120,流速为16 mL/min。分别经0、2、4、8、12、18、24、30、36、42和48 h取样1.5 mL,取溶液按“2.1.1”项下色谱条件测定,记录色谱图,计算释放量,绘制释放曲线,研究玻璃纤维膜孔径对释放度的影响,结果见图8~9。结果表明,半固体适配器半透膜的孔径大小对本品释放速度影响较大,膜孔径较小时,活性成分不能有效释放,因此确定半透膜孔径为2.7 μm。
3.4 体外释放度测定
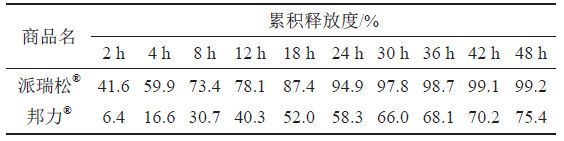
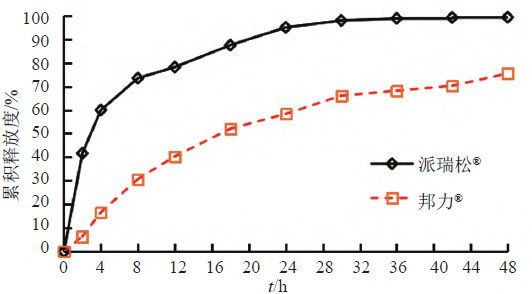
取A和B 两个生产企业样品各约0 . 1 g , 按“3.1.2”项下测定,分别经0、2、4、8、12、18、24、30、36、42和48 h取样1.5 mL,取溶液按“3.1.1”项下色谱条件测定,记录色谱图,计算释放量,绘制释放曲线,比较2个不同厂家体外释放曲线差异,结果见表6~7和图10~11。结果表明,邦力®与派瑞松®的两个活性成分溶出曲线均存在显著性差异。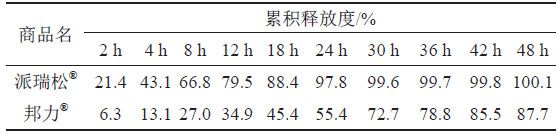
4.1 色谱条件的选择
本研究参照《中国药典》2020年版二部曲安奈德益康唑乳膏含量测定方法9,建立体外释放度测定方法,由于本研究未能获得两个厂家的所有辅料,因此专属性未能考察空白辅料溶液,但供试品溶液中两个主峰峰纯度角度均小于纯度阈值,说明两个主峰较纯,辅料不干扰测定。本方法准确度好、灵敏度高,能够准确检测低浓度或高浓度水平,具有评价两个主成分释放速率变化的能力。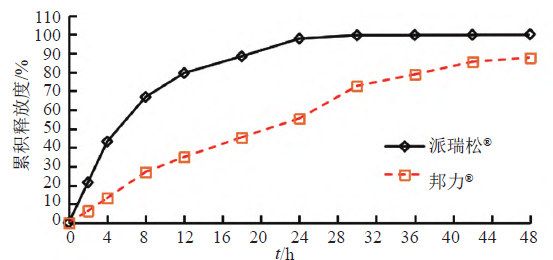
4.2 释放介质的选择
由于曲安奈德和硝酸益康唑均在水中极微溶解,必须选择合适的介质同时满足两种活性成分的漏槽条件。李震等8采用0.9%氯化钠注射液-无水乙醇(50:50,V/V)作为接受液,以Franz扩散池考察本品体外透皮吸收量,测定值显著性高于0.9%氯化钠注射液。由于本研究SOTAX流通池溶出仪未配置耐受有机相的标准池,故释放介质考察时加入了表面活性剂,并对表面活性剂的种类和浓度进行考察,以增加药物在介质中的溶解度,结果表明,选择含0.05%十二烷基硫酸钠的0.9%氯化钠溶液作为释放介质,对两个活性成分均能满足漏漕条件,采用闭合装置系统可满足测定要求,避免了开环装置介质需求量大的缺点。
4.3 放置方式的选择
流池法根据制剂特点配有相应的样品池,包括标准片剂池(内径分别为12 mm和22.6 mm)、半固体适配器、植入剂池等,对于半固体制剂,常用的放置方式有标准片剂池和半固体适配器。本研究考察了3种放置方式,结果表明:①标准片剂池底部加加玻璃珠的放置方式,玻璃珠能使溶媒形成层流状态,故释放更温和。②标准片剂池中加入半固体适配器的放置方式,药物需要从半固体适配器的玻璃纤维膜穿透,然后再溶解于释放介质中,因此释放最慢。本研究确定半固体适配器作为释放度测定的放置方式,避免因样品位置和高度差异引起RSD大的问题。
4.4 流速的选择
流池法中流速是影响药物溶出行为的重要参数,各国药典标准流速为4、8和16 mL/min,目前经常使用的是16 mL/min。本研究通过对不同流速的考察,以确定具有一定区分力的释放度条件。结果表明,在相同释放时间内,释放量随着流速的增大而增大,最终确定流速为16 mL/min,既能满足在一定时间内两种活性成分均有效释放,同时又具备区分力。
4.5 过滤装置滤膜的选择
另外,流通池还配置了一个过滤装置,以获得澄清的样品溶液,从而进行含量测定,但是所用的滤膜应是惰性,不能明显吸附溶液中有效成分。本研究分别以0.45 μm混合纤维素膜和0.45 μm尼龙滤膜考察释放行为,结果表明,采用0.45 μm尼龙滤膜时,硝酸益康唑48 h累积释放量约为80%,不能有效释放,因此确定过滤装置为0.45 μm混合纤维素膜。
4.6 释放行为差异的分析
本文2个生产企业体外释放度结果表明,邦力®与派瑞松®的曲安奈德释放曲线相比较,相似因子f2(选取10个点)为22.1,差异因子f1(选取10个点)为57.7,硝酸益康唑释放曲线相比较,相似因子(f2)为20.4,差异因子(f1)为57.1,说明二者释放曲线存在显著性差异,派瑞松®两个活性成分释放明显快于邦力®。经分析,邦力®与派瑞松®Q1、Q2和Q3均差异显著,Q3结果表明,派瑞松®乳滴粒度(5.71 μm)虽然大于邦力®(2.55 μm),但是派瑞松®活性成分粒度(32.36 μm)显著性小于邦力®(149.82 μm),说明活性物质粒度可能是影响释放差异的主要因素之一。
本文作者对曲安奈德益康唑乳膏的释放度检查进行了初步研究,筛选出具有良好区分力的流通池法体外释放试验方法,可用于本品质量控制,并指导处方及工艺研究。前期研究结果表明,本品推荐采用Janssen-Cilag Limited在法国上市的Pevisone®作为一致性评价的参比制剂(reference listed drug, RLD),但本次研究未能获得该参比制剂,故市售产品与RLD体外释放行为的差异还有待后续研究,从而为国内生产企业该品种一致性评价提供数据支撑。