时间:

翻译:华溶应用中心
审核:工业药剂发烧友
Amp B是两性霉素B的脂质体制剂,这是一种复杂的胃肠外抗真菌药物,迄今为止尚未获得美国食品及药物管理局批准的仿制药版本。对于通用Amp B脂质体产品开发,药物释放曲线的检查对于产品质量控制和与列出的参比药物的分析可比性评估非常重要。然而,目前尚无Amp B脂质体的标准化体外药物释放(IVR)试验。在本研究中,我们描述了基于USP-4流池法溶出仪的IVR试验的开发,该试验能够根据药物释放谱鉴别Amp B脂质体注射剂。IVR试验开发的目标是确定释放介质组成和试验温度,能够在24h内促进Amp B脂质体70-100%的药物释放,而不会出现Amp B沉淀或脂质体结构破坏。我们发现,在5%蔗糖、10% mM HEPES和0.01% NaN3(pH为7.4)的释放介质中添加5% w/v β -环糊精可防止Amp B沉淀并促进药物释放。IVR分析温度的增加导致药物释放速率的增加,故选择55°C作为在不引起样品沉淀的情况下促使药物释放达到溶出平台的最高温度。所开发的IVR试验用于区分Amp B脂质体和Amp B胶束产品(如Fungizone®和Fungcosome)的药物释放速率。IVR试验还能够区分与AmBisome®成分相同但通过挤出或均质工艺制备的Amp B脂质体,这两种工艺均导致可测量的脂质体粒度异质性和Amp B浓度差异。最后,使用USP-4 IVR分析比较了Amp B与印度批准的两种仿制药Amphonex®(Bharat Serum and Vaccines Ltd.)(f2为66.3)和Phosome®(Cipla Ltd.)(f2为55.4)之间的Amp B释放曲线。总之,所开发的USP-4 IVR测定法可作为仿制药Amp B脂质体制剂开发中药物释放图谱表征的有用工具。
两性霉素B脂质体注射剂
体外药物释放试验
USP-4流池法溶出仪
仿制药产品特性
AmBisome@是两性霉素B的脂质体制剂,于1997年首次进入美国市场。目前,它是许多侵袭性真菌感染和内脏利什曼病或血液恶性肿瘤患者接受化疗和器官或同种异体骨髓移植时最广泛使用的治疗方法。AmBisome@的年销售量超过3.5亿,2016年美国专利到期,是仿制药的主要目标。然而,对于所有复杂注射给药制剂,开发Amp B脂质体注射剂仿制药一直具有挑战性。难点在于,对于AmBisome@等药物而言,不仅是产品成分,工艺制造步骤也会显著影响产品的整体功效和安全性。由于Amp B在水溶液中的溶解性差,并且需要在脂质体双层中与二硬脂酷磷脂酷甘油(DSPG)进行AmpB络合,因此AmBisome@生产工艺相当精细。为确保Amp B脂质体的稳定性,为该产品选择的脂质混合物必须具有高相变温度,因为许多生产步骤必须在高达65°C的温度下进行。此外,AmBisome@的平均脂质体粒度相当小(小于100nm),多分散性低,需要高度控制粒度减小,以实现自制制剂和参比制剂之间的特性匹配
此外,产品的许多理化特性决定了AmpB在体内的释放速率,这与动物和人类的毒性直接相关。这些产品质量特性包括薄膜中Amp B的物理状态、脂质体粒度均匀性、脂质体相变温度和未包封药物的量。为确保实现所需的产品特性,几个Amp B脂质体生产步骤至关重要。这些工艺参数包括:有机相中脂质体组分浓度、有机相组成、组分混合顺序、均质条件和产品冻干参数。
虽然已有几个AmpB脂质体仿制药在美国境外获得批准,但由于产品安全问题,许多产品相继撤出市场。其中两种产品是最初在阿根廷获批的Anfgen@ (GenpharmaS.A.)和最初在印度获批的Lambin@ (Sun Pharmaceutical Industries) 。当将Anfgen@和Lambin@与AmBisome@进行比较时,基于LD-50值,这两种仿制药对小鼠的毒性是前者的2-10倍,并且在肺曲霉病小鼠模型中显示出较低的疗效。这两种仿制产品的处方组成与AmBisome®完全相同,仿制产品的功效和安全性的差异归因于AmpB的快速释放。因此,开发能够区分Amp B脂质体制剂的体外药物释放方法至关重要
最近,一些基于体外释放的IVR检测方法已用于表征多种特殊制剂如混悬液、聚合物微球和脂质体的释放特性, 与传统的“透析袋”和“样品和分离”的方法相比,这些VR分析具有一些显著的优势,包括使用标准USP-4溶出度仪、针对不同释放条件易于调节参数、无需采样的自动药物检测以及无外部干扰的闭环系统。可通过升高温度和在释放介质中添加增溶剂的情况下对复杂注射给药制剂进行USP-4溶出试验,以促进活性药物成分(AP)从高度稳定的脂质体、微球或混悬制剂中释放。所有这些优势将极大地有助于建立一种稳定且可重复的AmpB脂质体制剂的IVR检测方法。
我们在这里介绍了使用USP-4溶出仪进行AmpBIVR分析的开发,该溶出仪能够区分AmpB脂质体和其产品的相似处方,这些产品的组成与AmBisome@相同,但表现出不同的AmpB释放速率。将几种增溶剂添加到释放介质中,并筛选它们在不立即破坏脂质体结构的情况下提高AmpB溶解度和释放速率的能力。调节释放介质中的IVR分析条件(如温度、药物浓度和增溶剂浓度),以确保AmBisome@24h内释放超过70%的Amp B。IVR试验用于评估AmBisome@与两种仿制药Amphonex@ (Bharat Serumand Vaccines Ltd.)和Phosome@ (Cilpa Ltd)之间Amp B释放速率的相似性,这两种仿制药目前在印度销售。 其他基于胶束的制剂,如Fungizone@ (X-GenPharmaceuticals,FDA批准)和Fungcoome (上海新亚药业,中国批准),使用我们的方法表现出明显不同的释放速率。此外,在已建立的USP-4IVR试验中,使用与AmBisome@生产工艺不同的方法在内部制备的AmpB脂质体制剂(导致粒度分布略有不同)也表现出与AmBisome@相比不同的释放速率。我们还评估了USP-4IVR是否能够通过检查AmBisome@样品强制降解释放的药物来提供稳定性信息。 总之,建立的USP-4IVR测定可用于质量控制,以指导仿制药Amp B脂质体制剂的开发和仿制药的分析可比性测试。
2.1、 材料
AmBisome®(安斯泰来制药股份有限公司)和Fungizone®(X-Gen制药公司)从密歇根大学医院药房购买,两性霉素B(Amp B)、γ-环糊精(γ-CD)、羟丙基环糊精(HP - CD)和Fungcosome购自SHJNJ Pharmatech(中国上海), Amp B参比标准品购自USP(Rockville,MD),Amphonex®和Phoso ®由Bharat Serum and Vaccines Ltd. (印度孟买)提供。DSPG和HSPC购自Lipoid (Newark, NJ),胆固醇购自AvantiPolar脂类公司(Alabaster,Alabama),Floor-A-Lyzer ®透析管的分子量截止值为300kDa,购自美国加利福尼亚州兰乔多明格斯光谱实验室。蔗糖购自Fluka,十二烷基硫酸钠(SDS)、异丙醇、HEPES、α -生育酚、NaN3和所有其他试剂均购自西格玛。为确保定量分析的准确性,本研究中使用的所有缓冲液均在使用前制备。
2.2、方法
2.2.1. Amp B脂质体的制备
脂质体 (35:20-8; 35:41-4; 35:48-7)基于NeXstar的公开专利,并进行了一些修改。 首先,将33.6mg DSPG、85.2mg HSPC、20.8mg胆固醇和0.256mgα-生育酚加入含14.0µL水(2% v/v)的1mL乙醇中,加热至65°C,并搅拌溶解脂质。 将溶于0.3 mL DMSO中的20mg Amp B预热至65°C,并添加到脂质溶液中。将2.6 mL的70°C预加热缓冲液(10mM琥珀酸钠,10%(w/v)蔗糖,pH 4.8)加入Amp B/脂质溶液中,在70°C下间歇搅拌15分钟,并冷却至室温。在4°C下用缓冲液(10 mM琥珀酸钠,10%(w/v)蔗糖,pH 4.8)透析混悬液,并进行两次冻融循环。Amp B的目标浓度为0.7 mg/mL,以避免过滤时堵塞膜孔。将混悬液使用200nm聚碳酸酯膜过滤一次和80nm聚碳酸酯膜过滤七次,以获得最终的Amp B脂质体处方35:20-8。
将252 mg DSPG和150 mg Amp B加入7.5 mL MeOH/DMSO(7/2,v/v)中,加热至65°C,并加入150 µL H2O(2%,v/v)和124 µL 2.5M HCl,制备处方35:41-4。 将混合物在65°C下加热搅拌,直至所有组分溶解,并观察到透明橙色的DSPG/Amp B溶液。将639 mg HSPC、156 mg胆固醇和1.92 mg α-生育酚等其他脂质体组分在7.5 mL MeOH/DMSO(7/2,v/v)中,在65℃下溶解5min。将两种制备的溶液混合,并在65°C下再放置10min,然后加入73µL 2.5M NaOH。 在恒温65°C的夹套搅拌容器中,将脂质溶液加入到135 mL预加热缓冲液(10mL琥珀酸钠,10%蔗糖(w/v),pH 4.8)中,迅速搅拌15min后,冷却后,用十倍体积的缓冲液(10mM琥珀酸盐,10%蔗糖(w/v),pH5.5)置换,并通过切向流过滤浓缩至4mg/mL Amp B。 使用M-110P型微流化器(马萨诸塞州韦斯特伍德微流化公司)对脂质体混悬液进行均质处理,在10000 psi下处理七次,形成35:48-7,在20000 psi下处理四次,形成35:41-4。
2.2.2.Amp B脂质体粒度分析
测量前,添加0.9 mL释放介质或去离子水稀释0.1 mL Amp B脂质体,通过使用Malvern Instruments ZetaSizer 3000HSa(马萨诸塞州韦斯特伯勒)动态光散射测定室温下的平均粒径和多分散性。对于Amp B胶束制剂,在不稀释的情况下分析样品。所有样品重复分析三次。
2.2.3.高效液相色谱法分析Amp B浓度
采用配备UV检测器的高效液相色谱 (HPLC) 测量不同制剂中的Amp B浓度。 使用Higgins PROTO 300 C18柱(250×4.6 mm,5μm,Higgins Analytical Inc.,Mountain View, California)在室温下进行色谱分离。 流动相由 (A) 含0.1% v/v三氟乙酸的甲醇和 (B) 含0.1% v/v三氟乙酸的水组成,浓度梯度为60-84% A,运行时间9分钟,流速为1mL/min,检测波长为390 nm。将Amp B参比标准品溶于二甲基亚砜中,形成贮备液(4mg/mL),用甲醇稀释至80μg/mL,对于所有Amp B制剂,将100 μL样品溶于1mL DMSO中,然后用甲醇稀释至5mL。在高效液相色谱分析之前,所有样品在12000转/分的转速下离心10min,并根据峰面积使用外标法计算不同制剂中的Amp B浓度。
2.2.4.基于单瓶样品IVR分析AmBisome®释放条件筛选
对于释放介质组成的选择,将AmBisome®置于浸没在38.4 mL释放介质中的Float-A-Lyzer®(分子量截止值300 kDa)锥形离心管中,在单瓶的IVR分析中进行释放实验。简言之,用1.5 mL释放介质稀释0.1 mL AmBisome®或游离Amp B(4mg/mL)贮备液,然后置于Float-alyzer ®中(释放介质中的最终Amp B浓度为10μg/mL),将溶液在45°C下保温24h,并在180 rpm下振摇。所有考察实验的释放介质均由5%蔗糖、10mM HEPES和0.01% NaN3(pH为7.4)组成。考察了添加5% γ-CD、5% HP-CD、0.25% SDS或10% IPA对Amp B释放速率的影响,取0.1mL 4mg/mL的游离Amp B贮备液直接加入39.9 mL释放介质中作为对照品(10μg/mL)。以预定时间间隔取出溶出介质等分试样(300 μL),并用新鲜释放介质代替。 使用Synergy Neo HTS多模式微孔板读数器(BioTek仪器公司,VT,美国),通过414 nm的紫外吸光度测定不同时间释放的Amp B量。
为了考察单瓶IVR试验中释放条件对Amp B释放性能的影响,在45 ℃、55 ℃和60 ℃的温度下进行了释放研究。为了考察增溶剂浓度对Amp B释放的影响,测试了γ- CD1、2.5、5和10% (w/v) 的浓度。在总释放介质中,采用不同的Amp B初始浓度5μg/mL、10μg/mL和30μg/mL进行IVR分析,其他释放条件和实验步骤与上文所述相同。
如前所述,使用DLS分析比较了AmBisome®释放前后的平均粒径和PDI。在释放介质中稀释样品,并通过三个独立实验获得平均粒径。
2.2.5.建立用于区分AmBisome®和其他Amp B 处方制剂的USP-4 IVR检测方法
使用USP-4溶出仪(推荐使用华溶DS-7CP流池法溶出系统)检查了AmBisome®或其他Amp B处方制剂的Amp B释放情况。简言之,将含有样品的1.6 mLAmBisome®或其他Amp B处方制剂置于Float-A-Lyzer ®中(试管中的Amp B浓度等于0.5 mg/mL),然后插入USP-4流通池中,每个池体添加78.4 mL释放介质(Amp B的最终浓度为10μg/mL),将溶媒以16mL/min的闭环管路填充,并保持在55°C,通过紫外线吸收检测Amp B每小时的释放量。在方法开发阶段,将等量游离Amp B溶液(10μg/mL)直接与释放介质混合作为对照,以模拟Amp B从制剂中完全释放,并用紫外吸光光度法检测Amp B在释放期间的变化。 通过将每个时间点释放的AmBisome®或其他Amp B处方制剂释放的Amp B量除以Amp B对照溶液的释放量,计算累积释放量(%)。所有实验中的释放量均一式三份,结果报告为平均值±SEM。
通过此方法测试的Amp B处方制剂包括:(A) Micelle Amp B处方(Fungizone®, X-Gen Pharmaceuticals, Inc.美国);(b) Fungcosome,由中国上海新亚药业有限公司生产的混合胶束制剂;(C)具有与AmBisome®相同成分的通用Amp B脂质体制剂,如Amphonex®(巴拉特血清和疫苗有限公司)和Phosome®(Cilpa有限公司);(d)Amp B脂质体制剂,其组成与通过均质(35:41-4和35:48-7)或挤出(35:20-8)制备的AmBisome®相同。
使用以下公式进行f2测试,以比较AmBisome®和其他Amp B处方制剂的累积释放是否存在显著差异。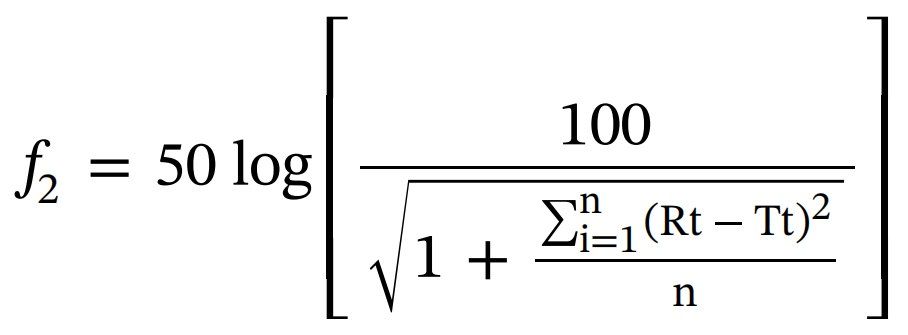
变量如下:n是时间点的数量,Rt是参比产品在时间点t (t>0) 的累积释放值,Tt是测试批次在同一时间点的累积释放值。 所有时间点的累积释放值(n=24)用于计算f2。 相似因子f2≥50的试验制剂被认为与参比制剂相似。如果 f2值为100,表明测试曲线和参比曲线相同,并且随着值变小,释放曲线之间的差异会增加。
2.2.6.验证USP-4流池法溶出仪IVR测定是否具备稳定性
瓶装AmBisome®根据生产说明进行水合处理,冷藏储存最长达七个月。 采用USP-4 IVR法对老水化样品和新水化样品进行分析,并计算f2值。此外,将水合AmBisome®等分试样在60°C下保温七小时、三天和七天。对强制降解样品和非强制降解样品进行了体外循环试验,并计算了f2值。
3.1.增溶剂对单瓶AmBisome®释放的影响
由于Amp B的水溶性较差,必须向释放介质中添加增溶剂,以确保下沉条件。 此外,通常在复合注射给药制剂的释放介质中增溶剂,以促进活性药物成分 (API) 的释放。 例如,在USP-4 IVR试验中,使用羟丙基环糊精溶解多柔比星并促进其从Doxil®中释放,同时添加乙腈和乙醇以促进依维莫司和左炔诺孕酮聚合物微球制剂的药物释放。为了快速筛选多种增溶剂,在45°C和振摇的条件下,在单瓶AmBisome®释放试验中进行了IVR分析。 为确保增溶剂的添加不会导致脂质体破坏,在放行研究结束时测量了AmBisome®的粒度。 当使用5% HP - CD或10% IPA作为增溶剂时,在释放介质中观察到Amp B沉淀(图1 a, b)。 由于Amp B沉淀,Amp B在释放介质(线C)中的总吸光度显著低于Amp B在添加0.25% SDS(图1c)或5% γ-CD(图1d)的介质中的总吸光度。 添加0.25%SDS可更快地释放AmBisome®(A线),但AmBisome®(A线)的粒度从119nm减小到23nm(表1),表明表面活性剂破坏了脂质体结构。 此外,从Float-A-Lyzer ®中释放的游离Amp B在含有0.25%SDS的介质中缓慢且达不到平台(B线),表明Amp B可能溶解在缓慢透过300 kDa膜的SDS胶束中。当将0.5% (w/v) SDS添加到地塞米松脂质体的释放介质中时,Bhardwaj等人观察到脂质体的类似结构破坏以及脂质体含量的立即释放。与SDS不同的是,在释放介质中加入5%的γ-CD,使游离Amp B溶液从Float-A-Lyzer ®中快速完全释放(图1d)。添加5%的γ-CD仅导致AmBisome®粒度微小增加,并允许24.2%的药物在45°C下24h内释放(图1d)。在5% γ-CD溶媒中进行IVR分析发现AmBisome®平均粒径从118nm增加至123nm,表明脂质体在药物释放试验期间保持完整(见表1)。基于该数据,选择γ-CD作为Amp B增溶剂,并进行了额外的IVR分析优化研究,以提高脂质体的药物释放速率。
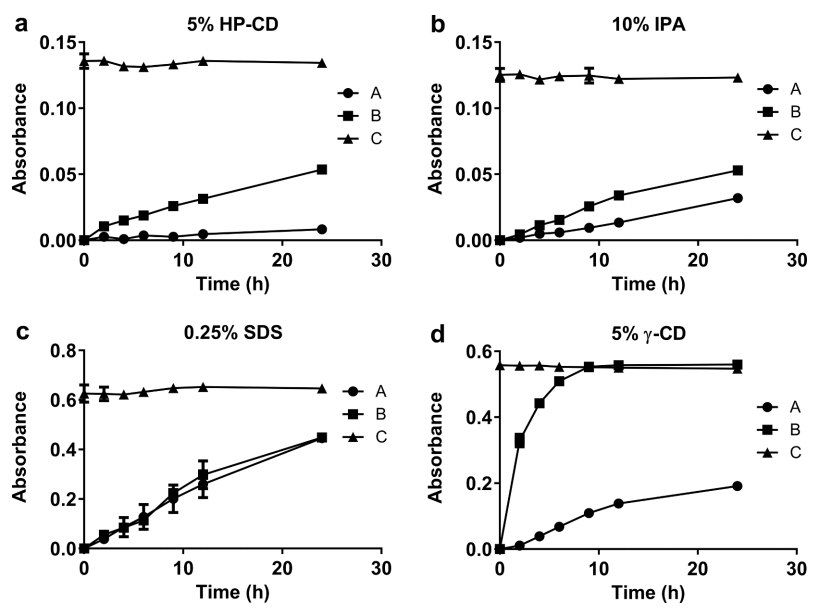
图1. 在45°C条件下,单瓶装AmBisome®试验中,增溶剂添加到释放介质中对Amp B释放的影响,包括5% HP-CD(a)、10% IPA(b)、0.25% SDS(c)或5% γ-CD(d)。曲线代表:A.AmBisome®在 Float-A-Lyzer® (●)中;b. Float-A-Lyzer®中的游离Amp B溶液 (■);C.释放介质中的游离Amp B (▲)。对于所有组,释放介质中的最终Amp B浓度为10µg/mL。
表1.不同释放条件对AmBisome®稳定性的影响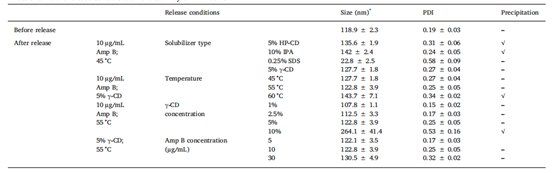
在释放研究完成之前和之后,使用释放介质稀释后,通过DLS测量粒径。
3.2.通过IVR测定温度、γ-CD浓度和Amp B浓度对单瓶AmBisome®释放的影响
本研究的总体目标是建立一种可在8-24小时内释放70-100%药物的IVR试验。时间要求来自对IVR分析方法的实际需求,该方法将在分析实验室进行批量分析。从脂质体制剂中释放70-100%的原料药,确保了IVR分析的鉴别能力,完全释放后,更有可能确定不同制剂之间的药物释放速率,进一步优化测定条件,以提高单瓶IVR测定的Amp B释放的完整性。通过差示扫描量热法测定,AmBisome®在56°C时相变温度较高,因为脂质体由完全饱和的磷脂和胆固醇组成。为了提高复合脂质体或聚合物微球产品的药物释放速率,IVR分析通常在接近或高于产品相变温度下进行。例如,Doxil®和Risperdal® Consta® USP-4释放试验均在45°C下进行。因此,为了提高Amp B的释放速率,在含有5% γ- CD的释放介质中,在45 ℃、55 ℃和60 ℃下进行IVR分析。如图2a所示,温度升高对AmBisome®的Amp B释放有显著影响,在45°C、55°C和60°C下分别有35%、76%和98%的累积药物释放。IVR分析温度的升高对Float-A-Lyzer ®中游离Amp B溶液的扩散速率没有影响(图2b)。当分析温度高达60°C时,AmBisome®的粒度适度增加,并观察到产品沉淀(见表1),表明AmBisome®在这种高温下不稳定。因此,选择55°C IVR分析温度进行后续研究。
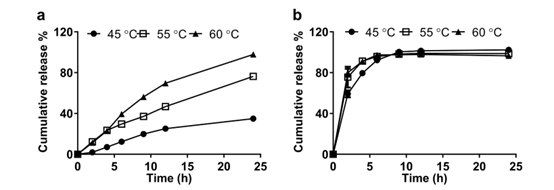
图2. 在不同释放温度下,通过单瓶的IVR分析,从Float-A-Lyzer ®中释放AmBisome®(a)和游离Amp B(b)。添加5% γ-CD到溶媒中,所有实验的总Amp B浓度为10µg/mL。
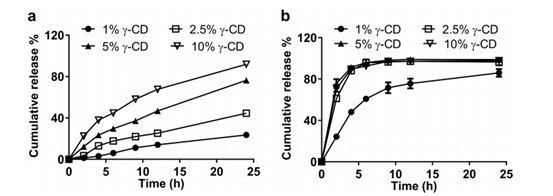
图3. 在55°C下,通过单瓶的IVR分析,在不同γ - CD浓度下从Float-A-Lyzer ®中释放AmBisome®(a)和游离Amp B(b)。所有实验的总Amp B浓度均为10µg/mL。
为了研究释放介质中γ-CD浓度对脂质体累积Amp B释放的影响,我们在释放介质中添加1%、2.5%、5%或10% γ-CD (w/v) 进行了研究(图3),所有实验均在55°C下进行。添加1% γ-CD后,从Float - A-Lyzer ®中释放游离Amp B溶液的速度缓慢且不完全,表明药物在1% γ-CD中的溶解度有限(图3b)。对于其他 γ-CD浓度,Float-A-Lyzer ®中游离Amp B溶液的释放迅速且完全。 我们观察到随着 γ-CD浓度的增加,AmBisome®的药物释放速率逐渐增加(图3a)。这可能是由于Amp B通过 γ- CD与脂质体表面胆固醇结合而增加了溶解度。胆固醇的去除可有效提高脂质体的流动性,降低有效相变温度,从而加快Amp B的释放,降低脂质体的稳定性。在建立基于USP-4的Doxil® IVR分析之前,我们已经观察到这种效应,在释放介质中添加10% γ-CD时,这种现象最为明显,24h释放后AmBisome®粒度从118.9nm显著增加到264.1nm(表1),表明脂质体可能聚集。由于释放研究期间AmBisome®粒度显著增加,后续研究中未使用10% γ-CD。在最终IVR试验中,选择了5%(w/v)γ-CD作为溶媒组分,以确保在试验期间药物释放相对完整,而不会出现脂质体聚集。
通过调整Float-A-Lyzer®中脂质体的体积,研究了Amp B浓度对AmBisome®累积释放的影响。为了在5μg/mL、10μg/mL和30μg/mL的释放介质中达到最终的理论Amp B浓度(假设药物释放率为100%),将0.05、0.1和0.3 mL的AmBisome®(4mg Amp B/mL)添加到Float-A-Lyzer®中,并使用80mL的释放介质。在所有浓度下仅观察到24小时释放的药物量存在微小差异(图4a),因此,所有后续研究均使用10μg/mL Amp B浓度,因为它为释放药物的紫外线检测提供了足够的灵敏度,并为进行IVR分析提供了最低要求的Amp B脂质体量。
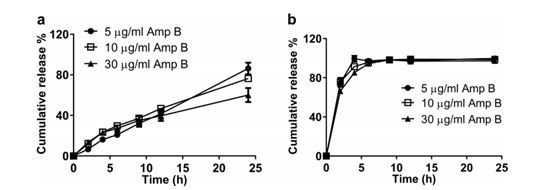
图4.在55℃,5% γ-CD的条件下,通过单瓶IVR检测不同Amp B浓度下Float-A-Lyzer®中AmBisome®(a)和游离Amp B (b)的释放。
3.3.基于USP-4流池法溶出仪AmBisome®体外分析方法的优化
根据实验结果,在USP-4流池法溶出仪的基础上对单瓶IVR分析中的优化释放条件进行了调整。在闭环中于55°C下进行IVR分析,溶媒以16mL/min的速度循环。最终释放溶媒由5%蔗糖、10% mM HEPES、0.01% NaN3(pH为7.4)和5% γ-CD组成。将0.2 mLAmBisome®(4 mg/mL)与1.4 mL释放介质混合,将脂质体或胶束置于最终浓度为0.5 mg/mL的Float-A-Lyzer®中,最后,在USP-4溶杯中加入78.4 mL溶媒,使释放介质中的最终Amp B浓度达到10μg/mL(假定药物释放率为100%)。
在USP-4 IVR试验装置中,AmBisome®中Amp B的释放与基于单瓶的IVR试验相似,24h内约有75%的药物释放(图5)。虽然选定的IVR条件为我们提供了区分Amp B各种脂质制剂的机会,但该检测存在一些明显的局限性。该测定在高于正常生理条件和5%γ-CD受体存在下进行,因此,IVR测得的释放速率可能与Amp B体内释放速率不同。此外,已知AmBisome®在体内给药后与内源性血浆脂蛋白相互作用,并被人体网状内皮系统吸收。需要指出的是,释放药物经过透析膜后测得的Amp B浓度可能与Float-alyzer®内脂质体释放的Amp B浓度不同,因为透析膜是药物的扩散屏障。Amp B从脂质体中的实际释放速率可以使用将Float-A-Lyzer®外部的实测药物浓度与薄膜内部的实际药物浓度关联起来的数学模型进行说明,正如Modi等人所做的那样。
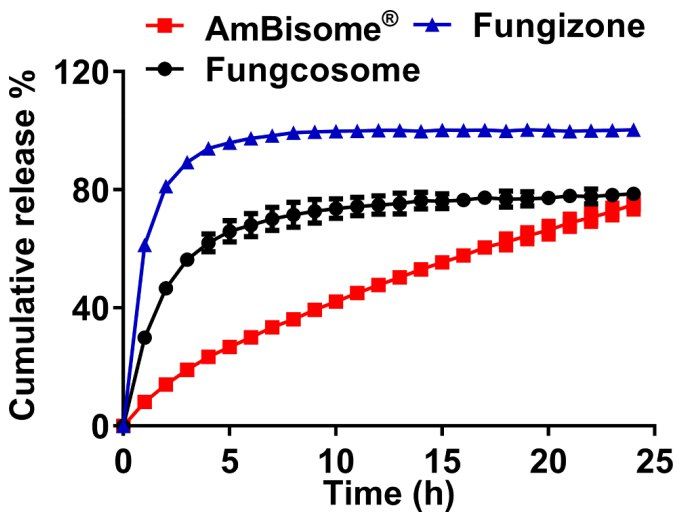
图5. 在55°C下,不同商业Amp B制剂在Sotax®上的累积释放。在溶媒中加入5% γ-CD,根据报告的包装说明书药物浓度,所有实验的Amp B总浓度为10µg/mL。
为了消除IVR测量AmBisome®中的Amp B缓慢释放的可能性,主要是由于释放的Amp B与脂质体表面结合,在空白脂质体存在的情况下测量了Float-A-Lyzer®中游离Amp B的释放。AmBisome®制剂中使用的相同比例的HSPC、DPPG和胆固醇来制备空白脂质体。空白脂质体和游离Amp B分别以与AmBisome®成分相同的比例(模拟100%的药物释放方案-高浓度)和低10倍的Amp B量(模拟10%的药物释放方案-低浓度)混合(补充图1)。在低药物浓度下,不存在或存在空白脂质体时均未观察到Amp B释放差异。在高药物浓度下,在空白脂质体存在的情况下,Amp B释放稍慢(延迟≤1小时),但仍比AmBisome®的药物释放更快。总之,释放的Amp B与脂质体表面的结合对IVR测试性能的影响非常有限。在https://doi.org/10.1016/j.ejpb.2018.11.010的在线版本中,可以找到与本文相关的补充数据。
3.4通过USP-4 IVR测定比较AmBisome®和市售胶束Amp B制剂
对适用于USP-4流池法溶出仪的IVR试验进行了区分脂质体和胶束Amp B产品的能力测试。将脂质体AmBisome®的药物释放与其他两种Amp B上市产品的药物释放进行了比较:由X-Gen Pharmaceuticals生产并在美国上市的胶束制剂Fungzione®,以及由上海新亚药业有限公司在中国上市生产的胶束和脂质体混合物Fungcosome。表2根据这些产品的包装说明书总结了本手稿中使用的所有Amp B产品的成分。Fungizone®是一种由脱氧胆酸钠和Amp B组成的胶束,在最初的6小时内表现出极快的药物释放,累积药物释放接近100%(图5)。Fungcosome囊体具有不同的组成,含有Amp B、脱氧胆酸钠和磷脂酰胆碱的混合物,平均粒径为653nm,相对Fungizone®囊体(180纳米)和AmBisome®(102纳米)大得多(表2)。尽管制剂不同,但在USP-4 IVR分析中,Fungcosome和Fungizone®的药物释放曲线相似,其特征是在6小时内快速释放达到稳定。该释放曲线表明,与脂质体相比,Fungcosome微粒体更像混合胶束制剂。有趣的是,Fungcosome的Amp B释放量未达到100%,这可能是由于用于USP-4试验的Amp B浓度4mg/mL(10mg/瓶,用2.5 mL 去离子水溶解)与我们使用高效液相色谱法测量的实际浓度2.8mg/mL之间存在差异。总之,这些结果表明USP-4方法能够将AmBisome®与其他非Amp B脂质体制剂区分开来。
表2. 与AmBisome®相比,不同Amp B制剂的组成、特性和释放f2值
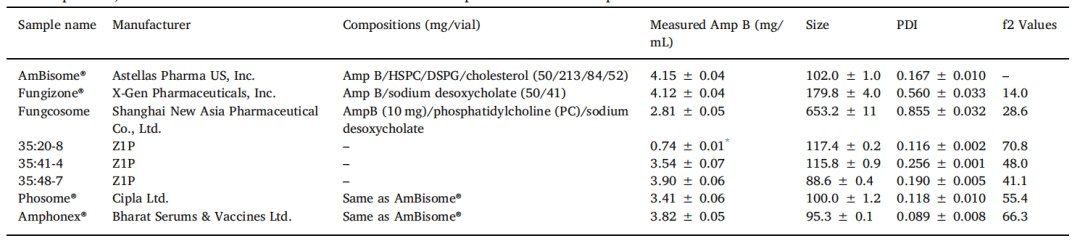
该处方在较低的目标Amp B浓度下制备,以辅助挤出工艺。 在USP-4 IVR分析中,根据总释放介质中Amp B的目标浓度10µg/mL进行稀释。
3.5 Amp B脂质体制备方法对USP-4 IVR药物释放的影响
对于复杂的仿制产品,不仅成分,生产工艺也决定药物释放。通过均质化或挤出工艺制备了三种不同的Amp B脂质体制剂,以探讨USP-4 IVR试验是否能够区分它们的药物释放特性。所有脂质体制剂均使用相同的药物与脂类重量比为Amp B:HSPC:DSPG:胆固醇=50:213:84:52制备。将这些组分溶于酸化的甲醇-氯仿(50:50) 中,依次混合,通过旋转蒸发干燥成粉末。用乳糖缓冲液对粉末进行水合并在65°C下搅拌,并将所得混悬液挤出或均质以减小脂质体粒度。使用Lipex挤出机在65°C下进行挤出,得到粒径分布窄、平均粒度为117.4 nm、PDI为0.116(表2)的Amp B脂质体(35:20-8)。为避免挤压滤芯堵塞,在低于AmBisome®4.0 mg/mL浓度的条件下,使用稀释的Amp B脂质混悬液(0.75 mg/mL)进行挤压。因此,测量样品35:20-8中的最终Amp B浓度为0.74 mg/mL,并再次稀释该制剂以进行药物释放和粒度分析。另外两种制剂在65°C、20000psi(35:41-4)或10000psi(35:48-7)下使用Microfluidics 110-PS均质器均质。当使用低压均质化时,需要通过M-110P微流化器七次,以达到目标脂质体粒度,平均粒径为88.6 nm,PDI为0.190(35:48-7)。当脂质体在高压下均质化时,需要四次才能达到目标粒径,并且脂质体会再次具有不均匀的粒径分布,平均粒径为113.7 nm,PDI为0.26 (35:41-4) 。
脂质体粒度分布的差异导致USP-4 Amp B释放量有差异。通过均质(35:48-7)制备的具有最小粒径的非均质脂质体表现出最快的释放速率,而通过挤出制备的具有较大粒径的均质脂质体表现出较慢的Amp B释放速率(35:20-8)(图6)。与AmBisome®相比,我们制备的所有制剂均能更快地释放Amp B,但计算出的用于评估释放曲线相似性的f2值显示,挤出脂质体35:20-8与AmBisome®之间具有高度相似性,f2值为70.8。相反,通过均质化制备的Amp B脂质体的f2值低于50,被认为与AmBisome®不同。除了生产工艺影响的脂质体粒径大小差异外,不能排除处方组分最终比例存在潜在差异的可能性。与Amp B浓度不同,未在最终产品中测量脂质组分浓度,这在某种程度上限制了我们对药物释放结果的解释。然而,这些数据表明,USP-4 IVR检测对区分不同工艺制备的脂质体制剂中Amp B的释放非常敏感。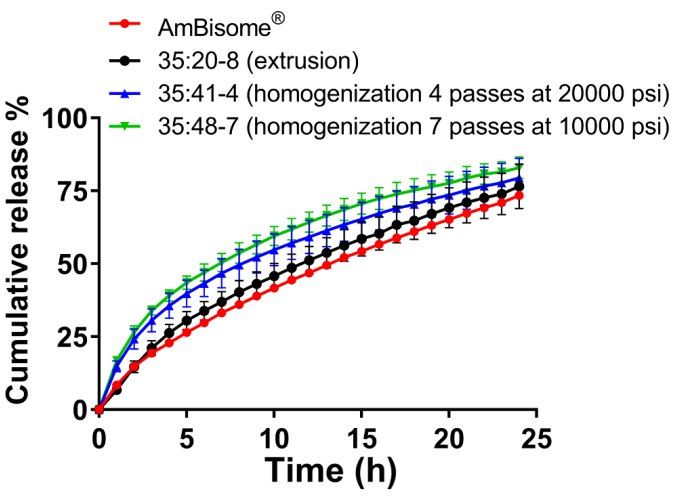
图6. 不同Amp B脂质体制剂的累积释放量在55°C下在Sotax®上由Z1P挤出和均质化制备而成。在介质中加入5% γ-CD,所有实验的Amp B总浓度为10µg/mL。
3.6.通过USP-4 IVR测定AmBisome®的强制降解对Amp B释放的影响
为了评估我们的AmBisome®含量测定是否获得稳定性信息,将水合AmBisome®样品冷藏储存七个月,并通过含量测定进行检验。与储存的产品相比,药物释放略快,但f2计算值为63.4,差异无统计学意义(图7a)。此外,水合AmBisome®样品在60°C下经受了八小时、三天和七天的强制降解,将强制降解的AmBisome®样品中的Amp B释放与实验前水合脂质体中的药物释放进行比较,结果显示,强制降解三天和七天的样品释放药物的速度更快,计算的f2值分别为55.5和39.5(图7a),然而,强制降解八小时的药物释放与非强制降解产品的释放相似,f2值为94.5,表明AmBisome®产品具有较高的稳定性。综上所述,我们的IVR分析似乎是稳定性指示性的,尽管轻度强制降解的AmBisome®样品与非强制降解的AmBisome®样品相比没有统计学显著差异,因为f2值通常超过50。缺乏统计学显著性可能是由于AmBisome®的高稳定性以及已建立的AmBisome®无法检测到产品的微小差异。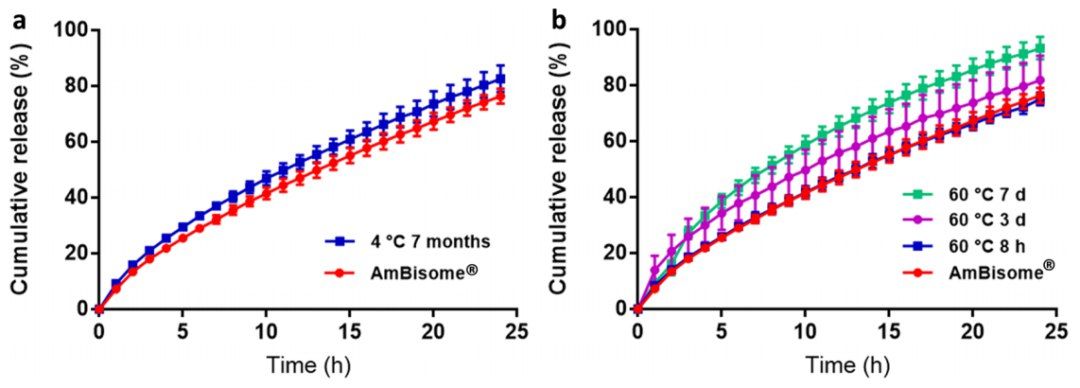
图7. 实验前水合AmBisome®、水合AmBisome®并储存在2-8°C下七个月(a)和水合AmBisome®并储存在60°C下八小时、三天和七天(b)的累积药物释放。 在55°C的条件下使用Sotax®进行IVR测试。在介质中加入5% γ-CD,所有实验的总Amp B浓度为10µg/mL。
此外,为了检测IVR分析从破坏的脂质体中区分药物释放的能力,我们在AmBisome®样品中添加了10%SDS,从而将浑浊的脂质体样品转化为粒径小于等于100nm的脂质-SDS- Amp B胶束澄清溶液(补充图2)。随后将AmBisome®与100:0、90:10、80:20、50:50和0:100比例的SDS裂解脂质体混合,破坏的脂质体和50:50混合物释放药物的速度非常快,但80:20、90:10混合物释放Amp B的速度仅略快于完整的AmBisome®。缺乏差异可能是由于脂质-SDS-Amp B胶束的形成,其也表现出Amp B的缓慢释放。总之,强制降解研究和SDS加成研究的结果突出了开发的IVR测定方法在区分能力上的一些缺点,以及开发脂质体产品的鉴别IVR测定的总体困难。
3.7.通过USP-4 IVR分析比较AmBisome®与在印度批准的仿制药
为了进一步检验USP-4 IVR试验的实用性,我们比较了AmBisome®和印度批准的仿制药Amp B脂质体制剂释放情况。虽然目前尚无FDA批准的仿制药Amp B脂质体制剂,但全球已批准多种仿制药。几年前,印度批准了AmBisome®的仿制药,其中一些仿制药的成分相同,另一些仿制药的成分略有不同。2016年,印度监管机构开会讨论了与批准的Amp B脂质体制剂相关的安全性问题,并针对健康受试者的额外14天毒理学和单次低剂量药代动力学评估提出了建议。 据我们所知,这一新的人体药代动力学可比性要求仅适用于由Bharat Serum and Vaccines Ltd.生产的Amphonex®和由Cipla Ltd.生产的Phosome®。因此,这两种产品仍可在印度市场上销售,本研究已采购这两种产品。根据包装说明书,Amphonex®和Phosome®的成分均与AmBisome®相同。我们分析了所有产品的粒径分布和药物浓度,观察到这两种产品的平均粒度和PDI分别为100.0/0.118(Phosome®)和95.3/0.089(Amphonex®),均接近AmBisome®(102.0/0.167)(表2)。水合脂质体溶液中的Amp B浓度分别为3.41 mg/mL和3.82 mg/mL,两种产品的标签浓度均与AmBisome®相同,为4mg/mL。虽然Amp B脂质体制剂之间存在一些可测量的差异,但由于可用性有限,每种产品仅分析一个小瓶或一个批次。使用USP-4 IVR分析从AmBisome®、Phosome®和Amphonex®中释放Amp B,表明这些产品之间存在相似性,两种仿制药均与AmBisome®相似,f2值大于50,但是,与AmBisome®相比,两种仿制药的药物释放都略慢(见图8)。计算得出的f2值显示,Amphonex®与AmBisome®之间的相似度(f2=66.3)略高于Phosome®与AmBisome®之间的相似度(f2=55.4)。重要的是,这些数值的统计能力有限,因为每个产品仅分析一个批次,了解批次间差异对于评估仿制药与创新药的相似性至关重要。此外,要证明USP-4 IVR检测能够区分AmBisome®和由印度监管机构从市场上撤出的仿制药Amp B脂质体制剂(如Anfgen®(Genpharma)或Lambin®(Sun Pharmaceutical Industries)),这将具有巨大价值。 然而,我们未能获得这些样品,仅表明IVR分析可区分通过高压均质法制备的AmBisome®和速释Amp B脂质体。总之,USP-4 IVR分析是评估AmBisome®与仿制药Amp B的相似性和差异性的有用工具。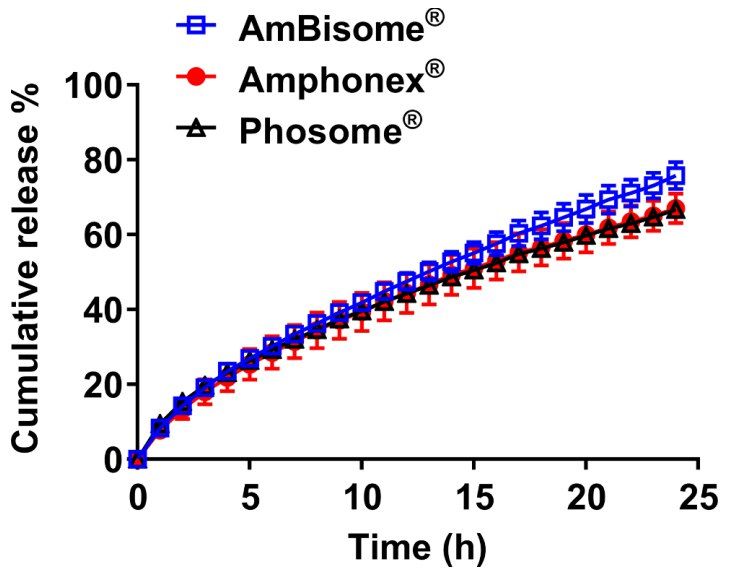
图8. Sotax®上不同仿制产品在55℃下的累积释放,溶媒中加入5% γ-CD,所有实验的总Amp B浓度均为10µg/mL。
虽然已建立的IVR测定法可以作为Amp B脂质体制剂的质量控制测试的有用工具,但该试验不能模拟体内药物释放,此外,我们不能声称IVR试验中更快速的药物释放与体内更快速的药物释放和产品更高的毒性相关,尚未确定IVR中产品性能与体内药物释放之间的体外-体内相关性(IVIVC)。这在设计在体外具有不同药物释放速率的Q1/Q2Amp B相同脂质体制剂或获得具有略微不同药物释放特性的商业制剂将非常有用。通过验证这些制剂的药代动力学并将体内性能与体外药物释放相关,可以建立IVIVC。我们将尝试在后续研究中建立IVIVC,等待速释和缓释制剂的采购,并从这些制剂中获得可靠的药代动力学数据。
建立了用于评价Amp B脂质体制剂的USP-4溶出仪IVR试验。IVR检测条件(温度55°C,释放介质中γ-CD受体浓度为5% w/v)与生理条件相差较远,在不破坏脂质体结构的前提下,优化了IVR检测条件以促进24 h内的药物释放,加速了药物释放,放大了制剂间Amp B初始释放差异。该IVR试验成功地用于区分AmBisome®脂质体和含有脱氧胆酸钠的Amp B胶束制剂(如Fungizone®和Fungcosome)。IVR分析能够区分内部使用不同方法制备的AmBisome®和Amp B脂质体制剂。对两种不同的Amp B脂质体和AmBisome®的药物释放曲线之间的相对一致性进行了评估,但在对这些印度仿制药的质量做出结论之前,需要对其他批次进行分析。总之,我们开发了USP-4 IVR测定法,可用于仿制药行业快速检测AmBisome®和类似Amp B脂质体制剂的药物释放情况。此外,IVR检测开发过程中应用的原理可供其他人应用,以便为其他复杂产品(如脂质体、纳米颗粒、微球、凝胶或混悬液)建立基于USP-4的IVR检测。