时间:

翻译:华溶应用中心
审核:工业药剂发烧友
Doxil®是FDA批准的一种复杂静脉注射多柔比星(DOX)脂质体制剂。对于多柔比星脂质体仿制药,分析DOX的释放曲线对于质量控制和可比性研究非常重要。然而,尚无可靠的多柔比星脂质体标准药物释放试验。在本研究中,我们阐述了一种基于USP-4装置的分析方法,能够根据释放曲线区分DOX脂质体制剂。在37℃的生理条件下,脂质体的DOX释放有限,从而阻碍了测定方法的建立。向释放介质中添加NH4HCO3有助于DOX释放,这与添加的盐浓度成比例,但这会导致释放的药物在流池法装置中沉淀。在释放介质中加入羟丙基环糊精 (HP-CD) 可避免DOX沉淀。我们通过改变HP-CD浓度、试验温度和试验样品浓度等参数,优化了DOX释放的条件。优化的释放介质包括:100mM NH4HCO3、75mM 2-(N-吗啉代)乙磺酸(MES)和5%(w/v)HP-CD、5%(w/v)蔗糖、0.02%(w/v)NaN3(pH6)。在45℃下进行药物释放试验,优化的释放试验可以区分不同处方、不同理化性质以及通过不同生产工艺制备的DOX脂质体制剂,这表明,该分析方法可用于比较DOX仿制药与创新药Doxil®的DOX释放。
Doxil®是一种多柔比星脂质体制剂,最初于1995年获得FDA批准,用于治疗不同的恶性肿瘤,如艾滋病相关的卡波西肉瘤、复发性卵巢癌、转移性乳腺癌和多发性骨髓瘤。Doxil®由美国强生公司(J&J) 销售,于2010年失去专利保护。Doxil®生产高度复杂,涉及多个工艺,包括形成多层载体、挤出形成单层脂质体、将多柔比星主动载入脂质体、缓冲液交换/纯化、无菌过滤和瓶装。由于产品的复杂性,该产品的仿制药发展受到限制。2013年,由Sun Pharma(印度)生产的第一款参照Doxil®的仿制药盐酸多柔比星脂质体注射液(如Doxil®)被美国FDA批准进口。多项分析测试以评估Doxil®及其仿制药的理化等效性。FDA关于多柔比星脂质体注射液仿制开发的个药指南,强调体外泄漏测试“以支持在一系列生理条件下没有不受控制的泄漏并向肿瘤部位细胞递送等效药物”。与可获得药典标准释放试验的常规剂型不同,对于复杂脂质体产品(如Doxil®),目前尚无药典标准释放试验,因此难以进行实验室间对比和脂质体仿制药的开发。因此,非常需要开发用于检测Doxil®等复杂脂质体制剂药物泄漏的标准释放试验。
流池法溶出仪近期已用于微粒和脂质体制剂的释放研究,结果令人鼓舞。因此,我们的目标是开发多柔比星脂质体的USP-4体外释放方法。与传统的释放试验(例如透析袋和“取样和分离”方法)相比,流池法释放试验用于多柔比星脂质体的优点包括:(a)使用标准流池法溶出装置;(b)易于调节释放试验的不同参数(如温度、流速和检测波长)的能力;(c)在线UV检测器连续自动检测多柔比星的释放,无需取样。总体而言,这些优势有助于建立稳健的释放试验,该试验受操作误差的影响较小,并且可在多柔比星脂质体产品生产商之间轻松转移。
在当前研究中,我们开发了流池法多柔比星脂质体释放试验,能够区分不同脂质体组成以及相同组成但通过不同工艺制备的制剂。在加速条件下,当超过70%的药物在24小时内释放时,已建立的流池法释放试验评估了多柔比星的渗漏。通过优化样品与释放介质的比例、温度、组成(如缓冲液组分)、氨离子加入量以及多柔比星受体环糊精的加入量,建立了测定方法。该方法可用于评估批与批产品的变异性、在生产工艺或设备变更后产品质量一致性测试,并为仿制药处方设计提供有用的反馈。它可以在未来用于潜在建立这些制剂的体外释放行为与体内药代动力学之间的相关性。
2.1 化学品和试剂
多柔比星购自SHJNJ PharmaTech(中国上海)和LC实验室(Woburn,MA)。脂质组分:氢化大豆磷脂酰胆碱 (HSPC);1-棕榈酰基-2-油酰基-Sn-甘油-3-磷酸胆碱 (POPC);1,2-二硬脂酰-Sn-甘油-3-磷酸乙醇胺-N-氨基(聚乙二醇)-2000 铵盐(DSPE-PEG2000)购自Lipoid(纽约),胆固醇购自AvantiPolar Lipids(Alabaster)。Doxil®是从密歇根大学医院药房购买。β-环糊精(β-CD)和羟丙基环糊精(HP-CD)由Roquette Pharma赠送。此外,HP-CD、β-CD和β-CD购自SHJNJ Pharmatech(中国上海)。NH4HCO3从Sigma购买。Float-a-lyzer®(截留分子量为10-300kDa)透析管购自Spectrum Laboratories。蔗糖购自Fluka。所有其他试剂均为分析级,从Sigma购买。为确保定量分析和释放试验的准确性,本研究中使用的所有缓冲液在使用前立即新鲜制备。
2.2 方法
2.2.1 多柔比星脂质体的制备
将HSPC、胆固醇和DSPE-PEG2000以3:1:1的重量比(表I)溶解在1mL乙醇(EtOH)中,制备脂质溶液。对于POPC -脂质体制备,用等量POPC取代HSPC(表I)。将混合物加热至65℃,直至所有固体完全溶解。通过向硫酸铵溶液中加入脂质形成多层脂质体(MLVs)(脂质加成法)。具体而言,将脂质/乙醇溶液倒入65℃搅拌的0.25M 硫酸铵溶液(L-DOXp)中,或高压注入65℃搅拌的0.25M 硫酸铵溶液(L-DOXi)中,并在相同温度下搅拌十分钟,然后挤出。随后以相同的方式处理MLVs以制备L-DOX。简言之,将Lipex挤出机(Northern Lipids, Burnaby, BC, CA)加热至65℃,并在添加MLVs之前用0.25M 硫酸铵溶液冲洗。在挤出机中加热MLVs 1分钟后,压力增加,直到出口管保持恒定流量。在室温下,通过动态光散射(DLS, ZetaSizer 3000HSa)测量,重复挤出大约六次,直到脂质体平均直径在85-90nm之间且多分散度(PDI)小于0.1。H-DOX通过与L-DOXp相同的方式形成MLVs,然后使用微射流机((Microfluidics M-110P, Microfluidics, Westwood, MA)进行高压均质化,特别是在10000-15000psi下进行两次均质化。通过透析法(4℃)在5 mM HEPES,10% w/v蔗糖(pH 6.5)条件下将脂质体从硫酸铵中分离。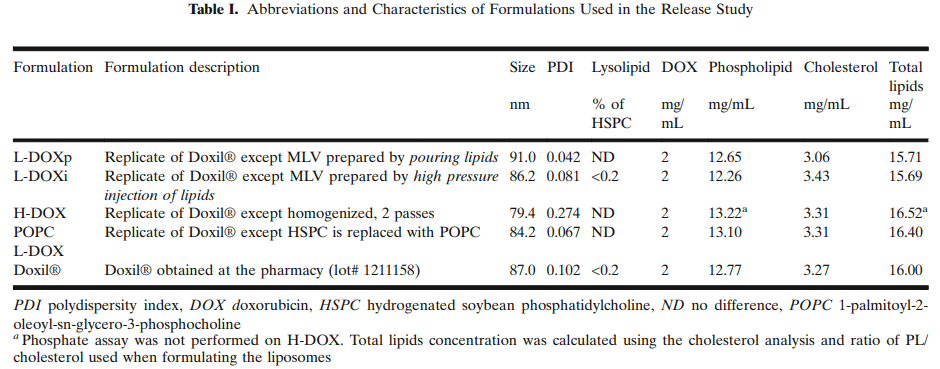
为了将多柔比星装入脂质体中,将盐酸多柔比星(DOX•HCl)粉末以10mg DOX•HCl/mL的浓度溶解在5 mM HEPES,10% w/v蔗糖(pH 6.5)中,然后以0.125 g DOX/g脂质的比例加入脂质体。将混悬液混合并60℃加热1小时,然后在冰水中冷却至少15分钟。未载入的多柔比星(DOX)通过对组氨酸1.55g/L、蔗糖94g/L(pH6.5)透析(4℃)从L-DOX中分离。所得脂质体制剂通过0.2μm注射器过滤器(聚醚砜)过滤,稀释至2.0mg DOX•HCl/mL,并在4℃下储存直至使用。
2.2.2 多柔比星脂质体的分析
采用HPLC法测定了不同脂质体制剂中DOX的最终浓度。在HPLC样品制备中,用990μL甲醇加入10μL多柔比星脂质体液相小瓶进行稀释。涡旋混合以破坏脂质体并溶解脂质体组分。配有等度泵和紫外检测器的高效液相色谱仪(Agilent 1100)进行分析。Zorbax eclipse XDB-C8柱(4.6 Å 150 mm, 5μm)用于分离并配备了C18反相键合硅胶柱(KJO-4282)和Cartridges C-8(AJO-4290),在254nm处检测DOX。流动相包括0.1% v/v三氟乙酸(TFA)水溶液(A)和0.1% v/v TFA甲醇溶液(B)。流动相以1.0 mL/min的流速在12分钟内以40%至100%流动相B输送,柱温30℃,进样体积为10μL。
使用等度泵、紫外可见检测器和蒸发光散射检测器(ELSD)HPLC(Agilent 1100)对胆固醇、磷脂和溶血素-PC浓度进行了分析。Zorbax eclipse XDB-C8柱(4.6 Å 150 mm, 5μm)用于分离,并配备了C18反相键合硅胶柱(KJO-4282)和Cartridges C-8(AJO-4290)。使用紫外-可见光检测器在205nm处检测胆固醇,通过ELSD分析磷脂,将其设定为以下条件:蒸发器温度为50℃,雾化器温度为88℃,氮气气体流速为1.0 L/min,光电倍增管为10,平滑度为5。高效液相色谱泵程序由以下条件组成:流动相为0.1% TFA水溶液(A)和0.1% TFA甲醇溶液(B),在91% B下等度洗脱,流速为1.0 mL/min;进样体积为20μL,柱温50℃;运行时间30分钟。以HSPC的mol%报告溶菌素-PC含量,定量限为HSPC的0.2mol%。使用标准磷酸盐测定法分析脂质体中的HSPC和PEG-DSPE含量。
使用MalvernInstruments ZetaSizer 3000HSa,通过动态光散射测定了室温下的平均粒径和多分散性,Zeta平均值在表I中报告。
2.2.3 透析装置膜的选择
在流池法溶出仪(推荐使用华溶DS-7CP PLUS流池法溶出系统)上装有8-300kDa截留分子量(MWCO)的Float-a-lyzer®检测透析管对多柔比星游离药释放的影响。简言之,将1.6 ml浓度为2mg/ml的游离多柔比星贮备液(在10% w/v蔗糖和10mg组氨酸/盐酸中,pH 6.5)置于透析管中并放入流通池池体中,并使用78.4 ml 10mM组氨酸-氢氯化物(His/HCl)、5%蔗糖和0.02%NaN3(pH 6.5)作为释放介质(释放介质总体积为80ml,释放介质中的最终多柔比星浓度(CDOX)为40μg/ml)。流速和运行温度分别设定为16ml/min和37℃。一式三份测定释放度,结果报告为平均值± SEM。
2.2.4 DOX脂质体流池法释放试验的建立
使用流池法溶出仪(推荐使用华溶DS-7CP PLUS流池法溶出系统)检测多柔比星的释放。简言之,将含有1.6 mL多柔比星脂质体样品(0.5、1和2 mg/ml浓度的L-DOX)置于透析管中,然后放入流通池池体中。每个池体使用78.4 mL的释放介质。将介质以16 ml/min的闭环系统灌注。
考察了释放介质温度、DOX浓度和释放介质组成对脂质体释放性能的影响,试验建立阶段在37℃、45℃和55℃下进行释放研究,并使用45℃的温度选择其他试验参数。在总释放介质中以10μg/ml、20μg/ml和40μg/ml的最终浓度进行释放试验,相当于向透析管中添加1.6 mL 0.5mg/ml、1mg/ml和2mg/ml的DOX脂质体溶液。还考察以下因素对释放的影响:HP-CD (1.5%、5%和20% w/v);β-CD(1.5% w/v)和γ-CD(1.5%和5% w/v)。释放介质中的NH4+浓度变化为0,25,50和100 mM。除非另有说明,释放介质中含有75 mM 2-(N-吗啉代)乙磺酸以控制pH和0.02%NaN3作为防腐剂。释放介质的初始pH为6,因为发现pH6可诱导约50%的DOX累积释放,这足够根据中试研究区分不同处方。在释放实验之前制备新鲜释放介质。
在方法开发阶段,将等量游离多柔比星溶液直接置于释放介质中作为对照,以模拟多柔比星从脂质体制剂中完全释放,并监测释放的多柔比星在释放期间UV吸收的任何变化。
释放的累积百分比: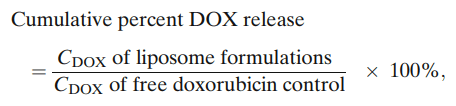
其中,脂质体制剂的CDOX是在特定时间点从脂质体释放到释放介质中的多柔比星的检测浓度,游离多柔比星对照的CDOX是在相同时间点的游离多柔比星的检测浓度。在所有条件下重复测定释放度,结果报告为平均值±SEM。
2.2.5 常规释放试验
常规释放试验用于研究没有特氟龙流通池体和管的情况下DOX的释放。简言之,将0.8 mL脂质体制剂(CDOX=2mg/ml)置于300kDa 透析管中,随后放入含有39.2 mL释放介质的50ml离心管中,总释放介质体积为40ml,总介质中的最终CDOX为40μg/ml。将离心管置于转速为320rpm/min的轨道振荡器上,并在37℃下孵育。使用等量游离多柔比星溶液作为对照。在设定时间点,抽取150μL释放介质样品,用酶标仪在480nm紫外线检测,并替换为等量的新鲜释放介质。使用早期公式计算DOX释放的累积百分比。
2.2.6 各种脂质体制剂DOX释放的最终分析和检测
最终优化的USP-4释放试验条件要求如下:(1)480 nm紫外检测;(2)截留300kda的Float-a-lyzer®透析管;(3)每次检测,将0.4 mL 2mg /mL DOX脂质体制剂与1.2 mL释放介质混合,在透析管中加入共1.6 mL稀释的脂质体溶液(0.5 mg/mL);(4)释放介质78.4 mL(总介质浓度为10 ug/mL DOX);(5)释放介质由5% w/v HP-CD、100 mM NH4HCO3、75 mM MES、0.02% NaN3和5% w/v蔗糖(pH 6)(简称5% HP-CD碳酸氢铵、MES、NaN3、蔗糖(AMNS))组成;(6)流速16 mL/min;(7) 温度45℃。
对各种DOX脂质体制剂进行了重复三次分析,并绘制了平均累积释放量和SEM图。通过f2试验,使用以下公式评估不同处方的DOX释放曲线之间的相似性或差异: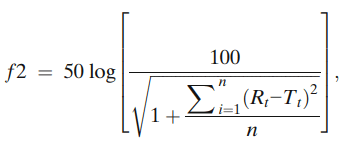
其中,n是时间点的数量,Rt是在时间t(t > 0)的参比批次的累积释放值,Tt是测试批次在时间t(t > 0)的累积释放值。所有时间点的累积释放值(n=24)用于计算f2。相似系数f2 ≥50被认为与参比处方相似。
为了确定每天的变异性,在三个不同的日期分析相同的样品;每天重复三次。报告了7小时和24小时多柔比星累积释放的平均值、SEM和方差。还计算并报告了f2。
3.1 多柔比星脂质体的制备与表征
制备了组成与Doxil®相同的脂质体制剂,并对其进行了表征,用于流池法药物释放试验开发。在表I中总结了组成、制备脂质体所用的方法及其分析特性的差异。脂质体的平均大小和多分散性指数(PDI)通过DLS测量,并且在表I中报告了Zeta平均值。通过不同HPLC方法测定了脂质体的多柔比星、溶血素-PC和胆固醇含量。用标准磷酸盐测定法测定磷脂含量或HSPC和DSPE-PEG2000的总和。总脂是磷脂和胆固醇含量的算术均值(表1)。
L- DOXp和L-DOXi的MLV制备方法有所不同。L-DOXP为将含脂乙醇溶液倒入搅拌下的硫酸铵水溶液中,L-DOXi为高压注入。虽然L-DOXi和L-DOXp的平均尺寸和多分散性非常相似,但L-DOXp释放DOX速度更慢,如下文所述。为了进一步研究生产工艺对多柔比星释放的影响,我们采用均质法制备了脂质体。与挤出制备的脂质体相比,所得脂质体的平均粒径略小,PDI更高。通过均质制备的脂质体释放DOX比挤出制备的脂质体更快。为了研究流池法试验是否能够区分缓释和快速释放制剂,我们用等量的POPC取代HSPC制备了脂质体。POPC熔融温度(-2℃)比HSPC(53℃)低,因此预计DOX会更快释放。虽然HSPC替代POPC略微改变了脂质与DOX的摩尔比,但质量比保持不变。
3.2 透析装置膜的选择
透析袋/透析管可用作屏障,使释放的多柔比星快速扩散到释放介质中,同时保留仍包封在脂质体中的所有多柔比星。为了找到能够满足这一要求的特定透析袋/管膜,通过在透析袋中直接添加游离多柔比星溶液来测试具有不同MWCO和材料的膜,以模拟所有药物分子从脂质体中释放的条件。
结果表明,采用100-300kDa MWCO的Float-a-lyzer®CE膜可快速释放多柔比星,在37℃下的7h内释放几乎100%的多柔比星,而采用8-10kDa MWCO的膜在24h内仅观察到33.9% ±2.2%的累积释放(见图1),100和300kDa MWCO膜的DOX转运速率无显著差异,因此所有后续研究均使用300kDa MWCO膜。100-300kDa MWCO膜的孔径范围为5-8nm,比我们的脂质体粒径小得多。因此,仍包封在脂质体中的多柔比星不会穿过膜。此外,释放24小时后,在释放介质中未检测到脂质体,HPLC检测没有磷脂即可证明这一点。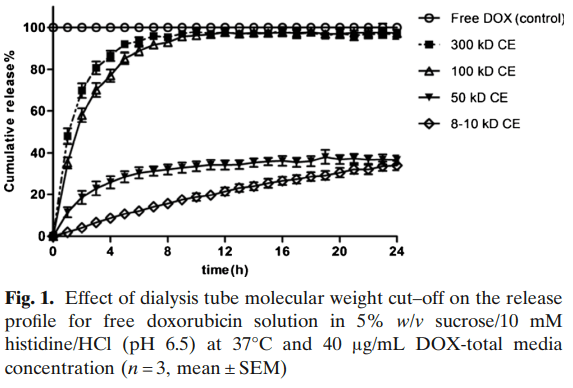
3.3 多柔比星释放试验初步开发
3.3.1 解决释放介质中的DOX沉淀问题
在确定了游离多柔比星的适当透析膜后,在SOTAX ®流池法溶出仪上进行了多柔比星从脂质体的释放试验。建立了游离DOX溶液在各种释放介质中0-45μg/ml的标准曲线,包括10mM His/HCl和5%蔗糖(pH=6.5)、PBS(pH=7.4)和100 mM NH4HCO3/5%蔗糖(pH 6.0)。使用进化阵列紫外可见分光光度计480nm检测DOX,并在0-45μg/mL浓度范围内观察到所有介质的良好线性。初步药物释放,在介质100mM NH4HCO3(5% 蔗糖,pH6)(图2a)或PBS(pH7)中以40μg/mL总DOX浓度进行实验,意外的是,在SOTAX ®流池法溶出仪的两种介质中均观察到DOX沉淀。进一步的研究表明,溶出仪的聚四氟乙烯表面形成了较小的红色晶体,随着时间的推移,其尺寸逐渐增大,最终导致多柔比星沉淀。为了探索仪器特氟隆表面或释放介质中的有限DOX溶解度是否为药物沉淀的原因,在聚丙烯离心管中进行释放(参见常规释放试验) 。在无聚四氟乙烯条件下,DOX沉淀的程度也较小。在离心管中加入特氟隆搅拌棒时,即使在DOX浓度低至3μg/ml下,也观察到在特氟隆表面上形成红色沉淀。为了避免在流池法溶出仪系统中释放期间沉淀,我们将羟丙基环糊精(HP-CD)作为DOX溶解度增强剂添加到释放介质中。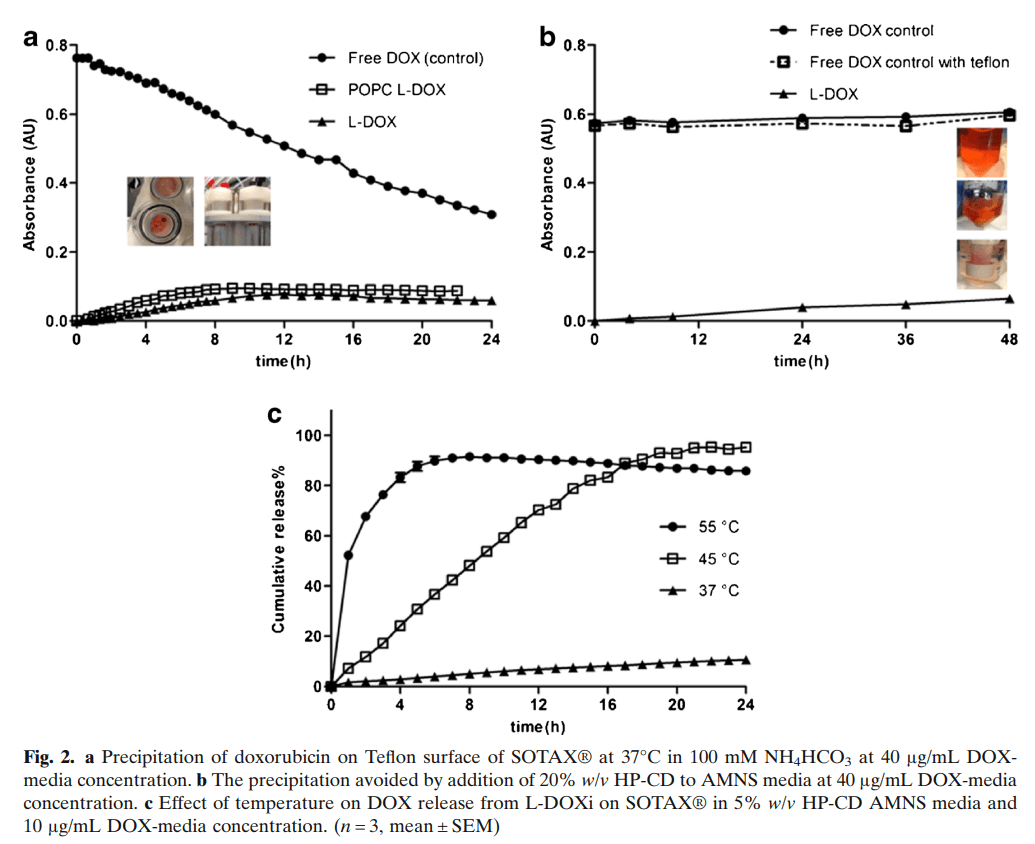
添加1.5%、5%和20%时,HP-CD可提高DOX在释放介质中的溶解度。在向释放介质中添加HP-CD之前和之后,使用常规测定进行释放研究,48小时内未观察到DOX沉淀。在常规分析中添加特氟龙表面并在介质中加入HP-CD不会导致多柔比星沉淀(图2b)。初始释放实验在37℃下于PBS,10mM his/HCl缓冲液或100mM NH4HCO3中进行,然而,仅在NH4HCO3缓冲液中观察到脂质体释放DOX。此外,DOX释放百分比在pH5-7之间高度依赖于NH4HCO3溶液pH。发现pH6 介质在24小时内诱导DOX的累积释放约50%,这足以区分基于中试研究的不同处方。然而,在37℃下释放DOX期间,100mM NH4HCO3/5% w/v蔗糖介质的pH从6增加至8,导致多柔比星的紫外吸收降低,这降低了分析准确度。此外,在含蔗糖的介质中观察到细菌生长。为避免pH在释放过程中增加,在释放介质中加入缓冲至pH6.0的75mM MES。在释放介质中加入75mM MES后,pH的变化非常适中,37℃下48h后,pH由6增加至6.2,DOX紫外吸收保持不变。向释放介质中添加防腐剂0.02% w/v NaN3可防止细菌生长。因此,我们选择了含NH4HCO3、MES和NaN3的释放介质进行进一步评估。我们将此介质缩写为“AMNS”(碳酸氢铵、MES、NaN3、蔗糖)。然而,即使在存在100mM NH4HCO3的情况下,通过常规释放试验(图2b),在37℃下24小时内DOX的释放程度有限仅约7%,因此需要探索增加释放速率的额外措施。随后进行的实验考察溶出系统温度对其释放的影响。
3.3.2 流池溶出系统温度对DOX释放的影响
多柔比星的释放与温度高度相关,7小时内多柔比星累积释放百分比为91.0%±1.6%、42.4%±0.6%和4.5%±0.1%的试验温度分别为55℃、45℃、37℃(图2c)。DOX脂质体主要组分HSPC的凝胶-液晶相变温度(Tm)为53 ℃。当温度高于Tm时,释放量显著增加,这不足为奇。选择45℃的温度进行后续研究,因为L-DOXi的累积释放百分比几乎在24小时内就可以释放完全(95.3% ±1.2%),但释放速率足够慢,可以区分处方之间的差异。
3.3.3 流池法溶出仪释放试验的优化
3.3.3.1 不同浓度L-D0X对DOX释放的影响
考察了L-DOX制剂与总释放介质的体积比对流池法中DOX释放速率的影响。L-DOX的标准浓度为2mg/ml。将L-DOX稀释至0.5、1和2mg/ml的浓度,并将1.6ml稀释的L-DOX置于Float-a-lyzer®透析管中,将透析管插入流通池体中,并向每个释放管路中添加78.4ml的释放介质。因此,100%的多柔比星释放会在总释放介质中产生10μg/ml、20μg/ml和40μg/ml的药物浓度。初始L-DOX浓度越低,多柔比星累积释放越高:分别在24h内释放了77.0% ±2.7%、60.9% ±0.6%和48.3 ±0.7%的mL(图3a),由于多柔比星检测最低浓度是精确的仪器中的浓度和多柔比星沉淀风险在最低浓度下较低,所有后续研究均使用总介质中的10μg/ml的多柔比星浓度(透析管中多柔比星浓度为0.5mg/ml)。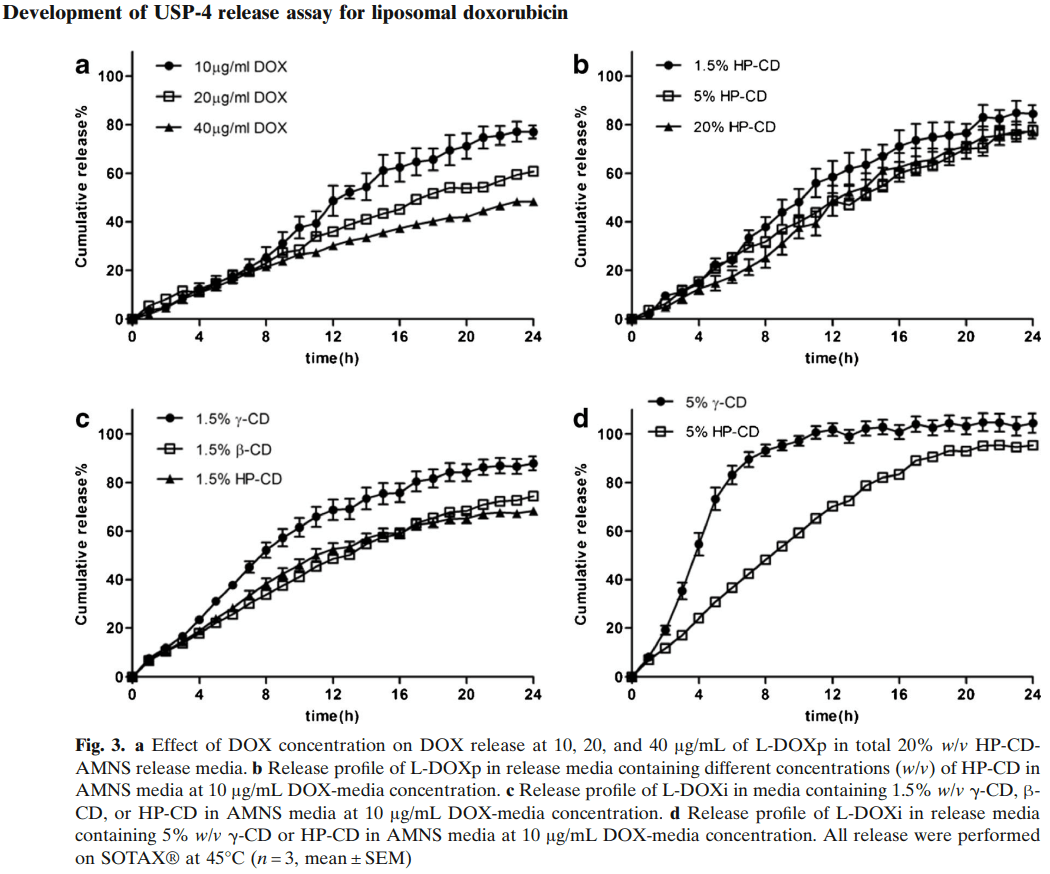
3.3.3.2 环糊精类型和浓度对DOX释放的影响
考察释放介质中HP-CD浓度对DOX释放的影响。含1.5%、5%和20% HP-CD的释放介质的累积药物释放没有显著差异(对于1.5%的HP-CD和5%的HP-CD,f2为53.1;对于1.5%的HP-CD和20%的HP-CD,f2为52.7;对于5%的HP-CD和20%的HP-CD,f2为68.7)(图3b),在含有5%和20% HP-CD的释放介质中未检测到多柔比星沉淀,但在使用1.5%HP-CD时出现微量沉淀。
为了比较环糊精类型对DOX释放的影响,将1.5%γ-CD、β-CD或HP-CD添加到含有100mM NH4HCO3、75mM MES、5%蔗糖和0.02%NaN3的释放介质中。由于β-CD的水溶性有限,实验在1.5%环糊精介质浓度下进行。与HP-CD和β-CD相比,γ-CD的DOX释放更快(图3c)。不幸的是,当三种环糊精仅在1.5%浓度下使用时,都观察到DOX的微量沉淀。为了避免DOX沉淀,对含有5%γ-CD和HP-CD介质的药物释放进行了研究。在含5%γ-CD介质中,在7小时DOX累积释放为89.5% ±3.1%,而含5%HP-CD介质中的累积释放为42.4% ±0.6%(图3d)。对于5%γ-CD释放介质,DOX释放太快,可能会降低区分不同L-DOX制剂的能力。此外,与HP-CD相比,γ-CD辅料成本更高,因此在释放试验中使用γ-CD是不切实际的。因此,在优化的释放试验中使用了5%HP-CD。
3.3.3.3 NH4+对多柔比星释放的影响
在流池法溶出仪上研究了释放介质中NH+浓度对DOX释放速率的影响。NH4HCO3释放介质浓度对DOX释放有显著影响(图4),在没有NH4HCO3的情况下,DOX释放非常有限,释放速率随NH4HCO3浓度的增加而增加。因此,100mM NH4HCO3释放介质用于后续研究。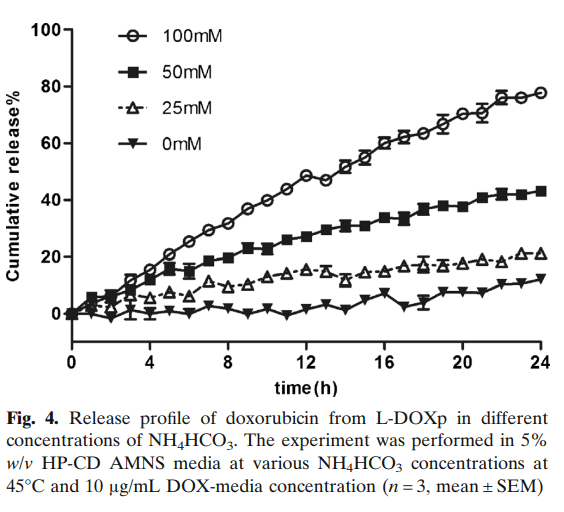
根据实验结果,确定了DOX脂质体的流通池法释放试验方法。优化后的释放介质组成为100mM NH4HCO3、75mM MES和5%HP-CD、5%蔗糖和0.02%NaN3(pH6)。在45℃下以16ml/min的速度循环释放介质,24小时检测DOX释放,释放介质体积为80ml,总释放介质中DOX的最终浓度为10μg/ml,相当于向透析管(Float-a-lyzer®)中添加1.6ml浓度为0.5mg/ml的DOX脂质体。
3.3.3.4 释放试验的有限确认
通过使用相同的L-DOXi制剂在三个不同的日期运行释放试验,通过前述优化的流池法溶出仪进行释放试验,分析了日间变异性。7小时和24小时的累积释放量分别为47.0%±1.6%和96.5%±0.7%,表明测定方差有限,释放曲线无显著差异(第1天和第2天的f2为73.4,第1天和第3天的f2为63.4,第2天和第3天的f2为81.0)(图5),对照DOX溶液的UV强度变化在四个不同的日期进行评估。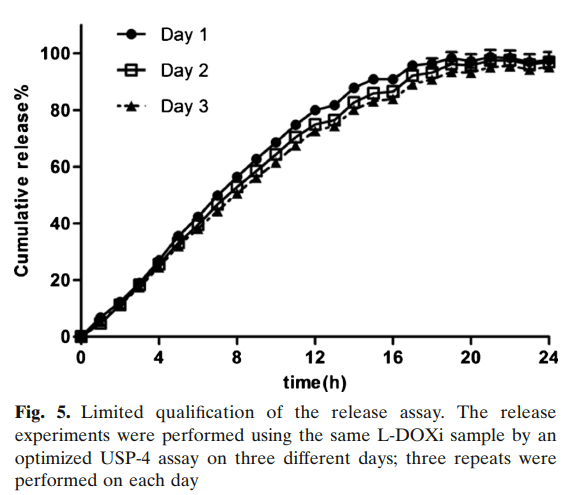
3.3.3.5 脂质体组成和制备方法对DOX释放的影响
为验证已建立的流池法释放试验区分DOX释放的能力,检查了各种脂质体制剂的差异(图6)。将市售的Doxil®作为对照进行分析。用POPC替代HSPC可在10小时内快速完全释放DOX(图6a)。所有其他脂质体的组成与Doxil®相同,但其理化性质略有不同。通过f2计算定量评估了这些处方之间的DOX释放差异(表2)。当f2值大于50时,认为两种处方的释放曲线相似。在表2中列出的多项比较中,这些比较的f2值小于50,并且认为它们的DOX释放行为彼此不同。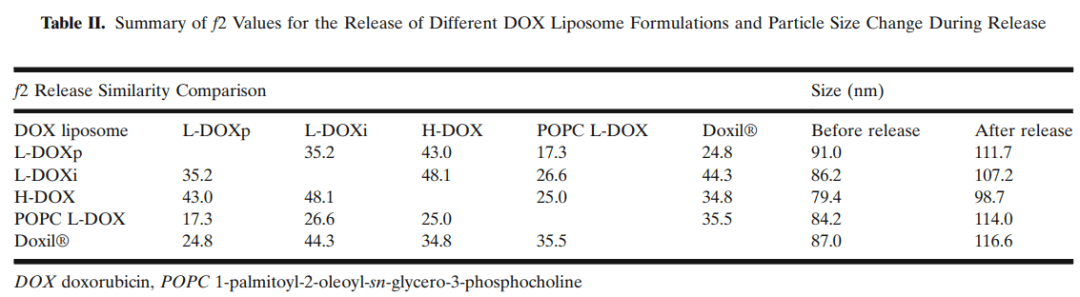
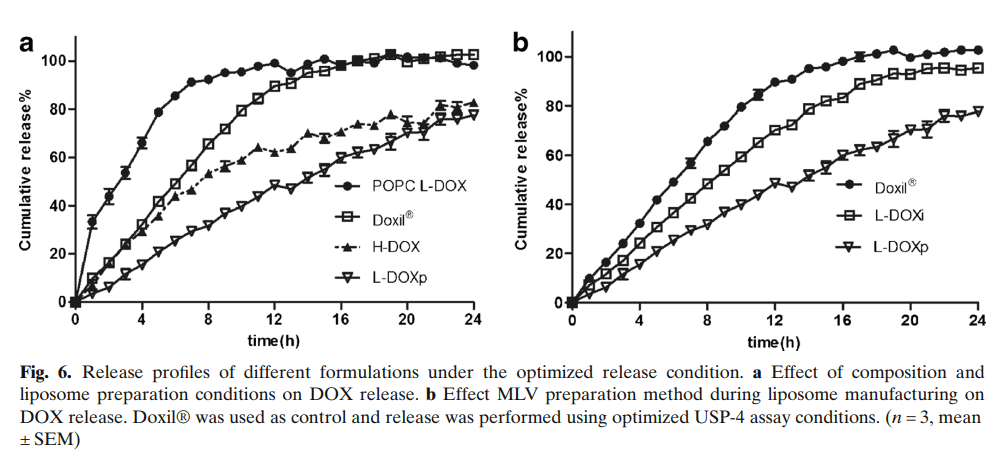
我们制备的所有制剂的DOX释放速率均低于市售Doxil®。在制备的脂质体中,使用高压均质(H-DOX)制备的脂质体比L-DOXp表现出更快的释放速率,24小时累积释放分别为82.9%±0.3%和77.7%±1.3%(图6a)。与L-DOXp平均粒径为91.0±0.1 nm相比,H-DOX(79.4±0.3 nm)的平均粒径更小,粒径分布更宽。H-DOX粒径的非均匀性可以解释DOX释放速率的加快。
在脂质体挤出之前制备MLV的方法也对DOX释放有影响。在硫酸铵水溶液中倒入脂质溶液制备的MLVs(L-DOXp)的DOX释放比在水溶液中高压注入脂质溶液制备的MLV(L-DOXi)要慢。此外,释放介质中存在环糊精和NH4HCO3不会导致以颗粒粒径发生剧烈变化为特征的脂质体崩解。在释放过程中,脂质体保持完整,并且仅进行了有限的颗粒尺寸增加(表2)。
选择释放介质是成功开发流池法释放试验的关键。虽然低离子强度介质10% 蔗糖和10mM his/HCl(pH 6.5)可以很好的溶解游离多柔比星,且不会引起明显沉淀,但该释放介质不能诱导多柔比星从脂质体中释放。同样,单独使用PBS也不会诱导多柔比星释放。近年来,有报道称肿瘤细胞可以通过谷氨酰胺分解产生氨,并诱导多柔比星从脂质体中释放出来。我们的初步研究还发现,当添加NH4+到释放介质中时,多柔比星的累积释放显著增加。此外,脂质体释放的多柔比星高度依赖于释放介质的pH和NH4+浓度。在100mM的相同NH4+浓度下,当释放介质的pH从4.5增加到7.0时,脂质体释放的多柔比星累积百分比从0%增加到80%, 同样,当释放介质中的NH4+浓度从0增加到100mM时,多柔比星累积释放百分比也会增加,这并不奇怪,因为多柔比星通过硫酸铵梯度法被加载到脂质体中,并且多柔比星可以在脂质体内硫酸盐存在下形成晶体。多柔比星作为游离有机碱,对脂质体的脂质双分子层具有高渗透性,但当其质子化并因此被捕获在脂质体内时,则具有低渗透性。氨盐在释放介质中pH依赖性分解后,NH3能够穿透脂质体膜,去质子化多柔比星,并促进其通过脂质膜的转运,当氨在增加pH被中和时,释放介质中的氨变得更通透。因此,较高的pH和较高的NH4+浓度可诱导更多的多柔比星释放。
然而,当使用含NH4+的释放介质进行释放测定时,多柔比星会沉淀在流通池体和特氟隆管路,即使在低至3μg/ml的多柔比星浓度下,聚四氟乙烯的管路也会导致沉淀。为了避免释放的多柔比星沉淀,HP-CD可以通过将客体分子封装在空腔中,将其溶解到释放介质中,因此,添加HP-CD后未发生沉淀。然而,在释放介质中使用环糊精通过不同的机制增强了多柔比星释放,环糊精能够从脂质体膜中提取胆固醇,从而提高膜的流动性和通透性。24小时释放研究完成后,对脂质体中残留胆固醇含量的HPLC分析以及释放介质的分析证实,有30%的胆固醇离开脂质体,并在5%HP-CD释放介质中也有发现。在血浆中,可能发生与循环脂蛋白从注射的脂质体中提取胆固醇类似的事件。
解决沉淀问题后,进一步优化该释放试验,以便在24小时内几乎完全释放多柔比星,从而提高试验的区分能力,因而评估了释放介质中的多柔比星浓度、释放介质组成以及温度的影响。温度越高,多柔比星释放速率越快,这并不奇怪,因为在更高的温度下,脂膜的流动性越高,膜的流动性有助于铵离子进入脂质体,多柔比星从脂质体中扩散出来,以及环糊精提取胆固醇。此外,在较高的温度下,NH3的生成速率较高,有效的多柔比星溶解度、扩散和解离常数较高,从而加快了分子的迁移和反应性。然而,过高的释放速率(55℃)或过低的释放速率(37℃)可能会掩盖不同制剂之间的任何轻微差异,因此,使用中等释放速率(45℃)作为释放试验的温度,这为区分不同制剂提供了更好的机会。
流池法测定的主要局限性在于测定条件本身确定了脂质体释放多柔比星的驱动力。因此,该试验可主要用于确定多柔比星脂质体制剂之间的相对差异,而不是确定体内相关释放行为。似乎NH4HCO3的存在和pH依赖性形成是溶解和释放多柔比星的关键驱动力。即使所有其他参数(如HP-CD和高温)保持不变,在小于25 mM NH4HCO3时观察到几乎没有多柔比星释放(图4)。L-DOX浓度分别为10μg/ml、20μg/ml和40μg/ml时,加快的多柔比星释放速率降低,这也归因于多柔比星-硫酸盐溶出期间透析管内NH4HCO3与多柔比星脂质体的比率较高和瞬态pH变化。虽然可以使用相同数量的NH3溶解多柔比星脂质体,但随后,它会溶解较高比例的总多柔比星,从而导致更完全的药物释放。
温度对释放速率也有明显的影响(图2c)。在含有HP-CD、MES和100 mM NH4HCO3的所有相同介质中,在37℃下几乎没有观察到多柔比星释放,在55℃下快速且几乎全部的药物释放在6h内达到平台,与在45℃下持续释放多柔比星形成对比。在55℃下,脂质体膜类似流体,因此多柔比星可以通过膜快速扩散,释放介质中HP-CD的存在有助于去除脂质膜中的胆固醇,减少膜的有效过渡,并提高多柔比星渗透性。显然,试验温度显著影响多柔比星的有效释放速率,最终选择的流池法参数与生理条件相差甚远。然而,加速释放条件已被其他研究者用于建立基于流池法的聚合物微球评估方法。在流池法试验中,使用pH2.4的极端释放介质pH、添加10% 乙醇以及45℃、50℃、53℃和60℃的高温来区分聚合物微球处方。
除释放介质组成和温度外,流池法释放装置的设置本身也会影响多柔比星释放。为了检测脂质体的药物释放,我们使用了透析装置插入USP-4装置。我们发现,透析膜代表了多柔比星从Float-a-lyzer ®扩散到USP-4流通池的扩散屏障,值得注意的是,高渗透性300 kDa透析管的释放存在滞后时间,这使我们对释放动力学的有效观察延迟了大约1小时(图1中50%释放的时间约为1小时)。因此,由于脂质体制剂的释放是在更长的时间尺度上观察到的(例如,半时间约7小时),我们正在观察药物从脂质体释放的动力学有价值的表现(图5)。然而,使用其他渗透率较低的50-10kDa透析膜会导致多柔比星溶液从Float-a-lyzer®中释放显著减慢和不完全释放。这种影响可能取决于药物的大小和疏水性,因此,对于难溶、分子量较大的药物,这种影响可能更为严重。
选择用于分析的最终条件与L-DOX的生理释放条件相去甚远。USP-4试验条件的主要优化标准是在12小时内从Doxil®中观察到超过80%的药物释放,以便能够在试验持续时间的24小时内区分具有更快或更慢多柔比星释放行为的脂质体制剂。实际上,当使用优化的释放试验来确定不同L-DOX制剂的释放曲线时,它能够区分慢释放和快释放脂质体制剂。例如,POPC L-DOX的释放速率比任何其他制剂都快,在10h内释放几乎100%的多柔比星。这并不奇怪,因为POPC的相变温度远低于其他脂质体制剂。相变温度较低的磷脂具有较高的流动性,这使得分子更容易通过脂质双层运输。我们还发现,组成相同但通过不同方法制备的制剂,以及具有略微不同理化性质的制剂,在体外表现出非常不同的释放,均质脂质体具有更宽的粒径分布(表1),与挤出制备的脂质体相比,多柔比星释放更快。通过均质化缩小MLVs粒径的工艺不能实现与挤出相同的粒径控制。脂质体粒径分布越大,某些脂质体的释放速率越快。MLV制备方法似乎对多柔比星释放速率有很大影响,因为L-DOXi的药物释放比L-DOXp快。脂类或硫酸铵的层状排列可能存在差异,有些脂质体或小粒径非均匀性低于DLS检测能力,需要通过对不同脂质体的显微镜分析进一步解释这种差异。
虽然未进行正式的分析验证,但有限的确认显示,在不同日期(图5)对同一L-DOX制剂进行的分析变异性较低,多柔比星溶液对照信号强度的日间变异性较低。然而,我们发现多柔比星释放速率强烈依赖于NH4HCO3溶液的离子强度和介质的初始pH。这可能与药物非临床试验质量管理规范(GLP)的含量验证存在潜在问题,因此,可能需要进一步优化氨盐浓度和pH,以提高分析耐用性。此外,在每次USP-4仪器运行中使用L-DOX标准制剂作为对照,并以与对照的百分比差异表示释放度结果,这可以在GLP分析验证中实施。
我们研究中采用的设计原理和选择适当释放条件的方法可能是开发其他通用复合脂质体制剂分析的有用范例。
使用含100 mM NH4HCO3、5%蔗糖、75mM MES、0.02%NaN3和5%HP-CD的释放介质,在45℃下用流池法溶出仪进行24小时的多柔比星脂质体释放试验。该释放试验用于区分不同工艺制备的相似多柔比星脂质体的差异。已建立的流池法试验可用于区分原研和仿制多柔比星脂质体之间的可能差异,为设计更好的制剂提供有用的反馈,并可能将这些制剂的体外释放行为与体内药代动力学联系起来。
略
如需原文,请联系小编 (代老师15012941165)