时间:

目的:基于分析方法质量源于设计(AQbD)理念,建立并优化吡罗昔康凝胶体外释放实验(IVRT)
方法:建立分析目标、确定关键分析属性[体外释放速率(IVRR)、初始采样时间累积释放量(Q0)、释放度];基于先前的知识与经验,从分析目标中推导出有影响的方法变量,并利用石川图进行系统总结,对影响的变量进行风险等级评估,筛选出关键方法变量(膜的种类、释放介质的种类、上样量);对2种上样量(150、300mg)、3种释放介质(0.9% NaCl 溶液、pH 5.5 的磷酸盐缓冲液和pH7.2 的磷酸盐缓冲液)和3种膜[混合纤维素膜(MCE)、聚醚砜膜(PES)、聚四氟乙烯膜(PTFE)]进行2×3×3全析因实验设计,采用扩散池法进行IVRT,将各时间点样品进行HPLC定量分析,进一步计算Q0、释放度和IVRR。利用JMP Pro 软件对实验结果进行建模分析,筛选最优参数。参考美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)要求对建立的IVRT进行膜惰性验证,释放介质验证,线性、精密度和重复性考察,敏感性和特异性考察及耐用性考察。
结果:吡罗昔康凝胶IVRT采用静态垂直扩散池(扩散面积1.767cm2,接收池体积12 mL),温度32 ℃,转速600 r·min−1,释放介质为pH7.2磷酸盐缓冲液、膜为MCE、上样量为300mg,取样时间为0.5、1.0、2.0、3.0、4.0、5.0、6.0h,取样方式为全部取样。方法学验证均符合要求。
结论:所建立的吡罗昔康凝胶IVRT可靠、耐用、具有区分力。

体外释放实验(IVRT)目的是测定药物从制剂中释放的速度和程度。口服固体制剂IVRT 可以建立生物药剂学分类系统(BCS)1和3类药物生物等效性,从而实现临床试验生物豁免。皮肤外用半固体制剂如软膏剂、凝胶剂、乳膏剂等的IVRT 亦是评价半固体制剂性能的有效手段,其测定的体外释放速率(IVRR)受原料药溶解度、粒径、剂型流变性、处方工艺等多方面影响,是制剂微观结构(Q3)的反映,是药品的关键质量属。欧洲药品管理局(EMA)、美国食品药品监督管理局(FDA)等监管机构已发布相关文件表示IVRT 可以作为生物等效性的评估工具替代临床试验,因此需要科学合理开发出可靠、耐用且具有区分力的IVRT方法。目前半固体制剂体外释放方法主要有流通池法、浸没池法和扩散池法。《美国药典》对这3 种方法均有收载,日本药局方收载了扩散池法,《中国药典》仅收载了流通池法且不是用来测定半固体制剂体外释放。其中扩散池因测定简便、重现性好被广泛使用。FDA发布的半固体制剂品种指南中,大部分亦推荐使用扩散池法进行IVRT研究。
分析方法质量源于设计(AQbD)是质量源于设(QbD)理念的延伸,其理念是通过设计而获得稳健且经济效益高的分析方法,目前已在高效液相色谱(HPLC)、超高性能液相色谱或快速分辨液相色谱等色谱方法开发中取得成功,该理念同样可以应用到IVRT方法的开发。
吡罗昔康作为非甾体抗炎药,具有解热、镇痛、抗炎作用。吡罗昔康对胃肠道有较大刺激性,而吡罗昔康凝胶经皮给药,可规避口服制剂引起的一系列胃肠道不良反应,具有局部药物吸收好、释药快等优点,临床主要用来缓解局部疼痛。目前尚无关于吡罗昔康凝胶体外释放研究的相关报道。因此,本研究以国内外半固体制剂、透皮制剂指导原则为依据,应用AQbD理念按以步骤利用扩散池建立吡罗昔康凝胶体外释放方法:建立分析目标、确定关键分析属性(CAA)、进行风险评估、识别关键方法变量(CMV)、实验设计、建模分析、方法验证。
2.1药物及主要试剂
吡罗昔康凝胶(黑龙江天辰药业有限公司,批号20220502,规格每支20 g);吡罗昔康对照品(中国食品药品检定研究院,批号100177-201704,质量分数99.5%);磷酸二氢钾、氢氧化钠、磷酸(分析纯,国药集团化学试剂有限公司);甲醇、乙腈(色谱纯,Merck 公司);混合纤维素膜(MCE)、聚醚砜膜(PES)、聚四氟乙烯膜(PTFE)(0.45 μm,天津市津腾实验设备有限公司)。
2.2主要仪器
岛津高效液相色谱仪(配备DGU-403在线脱气机、LC-40D二元泵、SIL-40C自动进样器、CTO-40S柱温箱、SPD-M40 PDA 紫外检测器),色谱柱为Waters SunFire C18(150mm×4.6mm,3.5μm);干加热自动透皮系统(推荐使用华溶TD-12AT PLUS 透皮扩散系统);CPX8800H-C 超声波清洗仪(美国Emerson 公司);XA205 十万分之一天平(梅特勒托利多公司);Milli-QIQ7000 纯水(MILLIPORE公司);JMP Pro16.0 软件。
3.1建立分析目标和确定CAA
分析目标即分析方法要达到的目标,是分析方法建立的基础,只有确定了分析目标,才能建立有效、耐用、风险可控的分析方法。CAA来源于分析目标,是分析方法质量优劣的表征,表1、2 列出了本实验的分析目标和CAA。

3.2 风险评估
基于先前的知识与经验,从分析目标中推导出有影响的方法变量,并利用石川图进行系统总结。对影响的变量进行风险等级评估,筛选出CMV。影响因素石川图见图1,风险等级评估见表3,上样量、释放介质类型、膜的类型是CMV。
3.3 实验设计
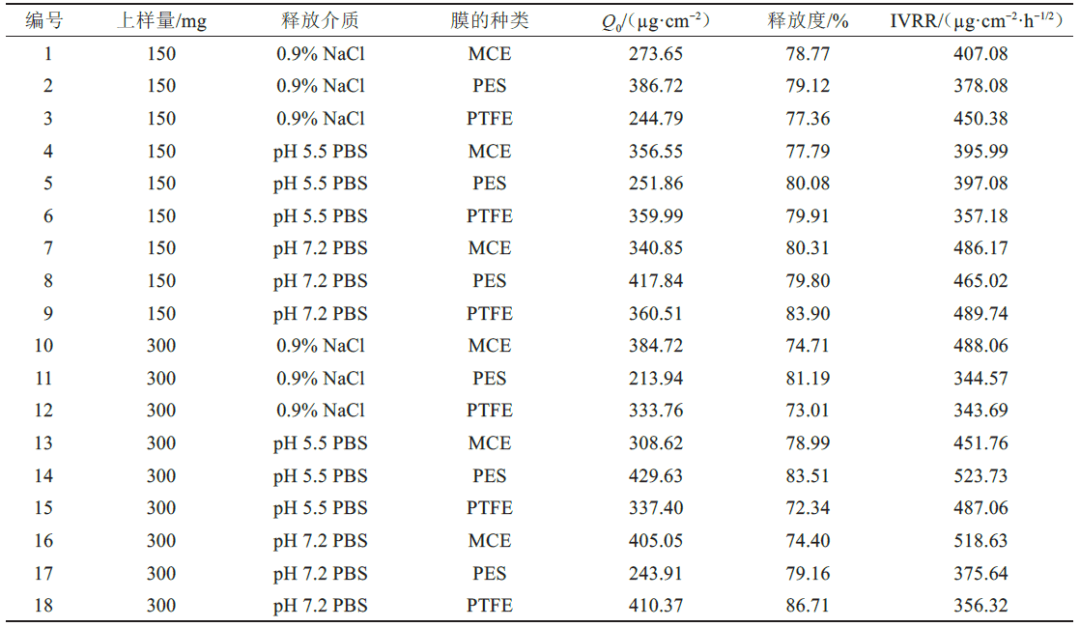
使用JMP 软件对筛选出的CMV 进行实验设计,包括2 种上样量(150、300 mg)、3 种释放介质(0.9% NaCl 溶液、pH 5.5 的磷酸盐缓冲液和pH7.2 的磷酸盐缓冲液)和3 种膜(MCE、PES、PTFE),实验设计结果见表4。
3.4 IVRT实验
IVRT采用静态垂直扩散池,温度32 ℃,转速600 r·min−1,取样模式采用全部取样,取样时间为30 min 及1、2、3、4、5、6 h。
将IVRT 实验中各时间点样品进行HPLC 定量分析,具体方法见“2.5”项,进一步计算Q0、释放度和IVRR(表4)。凝胶释放符合Hugichi 方程,即单位面积累积释放量(Q)与时间的平方根(√t)成正比,IVRR为Q和√t 的斜率。
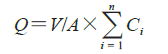
V为释放介质体积,A为释放面积,Ci为取样时间为i 时样品浓度,将i=30 min 代入上述公式即为Q0
释放度=Q/( A×上样量×0.5%)
3.5 吡罗昔康分析方法及验证
3.5.1 色谱条件
Waters Sunfire C18 色谱柱( 150 mm×4.6 mm,3.5 μm);流动相0.1%磷酸-乙腈(65∶35);检测波长352 nm;进样量10 μL;柱温30 ℃;体积流量1 mL·min−1。
3.5.2 溶液配制
稀释剂:pH 7.2磷酸盐缓冲液;对照品储备液:精密称取10mg吡罗昔康对照品至10 mL 量瓶中,用甲醇稀释并定容;对照品溶液:将对照品储备液稀释至30 μg·mL−1。供试品溶液为IVRT实验的样品。
3.5.3 专属性考察
精密量取对照品溶液、释放1h样品溶液、释放介质溶液进样测定,记录色谱图,见图2。结果表明,在该色谱条件下,理论板数为13 205,目标峰与相邻峰能达到基线分离,分离度大于1.5,本方法满足检测的需要。

3.5.4 进样精密度考察
取对照品溶液,连续进样6次,吡罗昔康峰的保留时间和峰面积的RSD均小于2%,表明仪器精密度良好。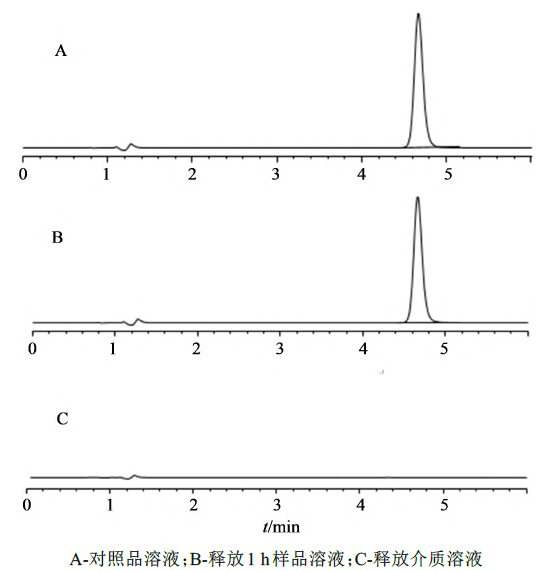
3.5.5 线性关系考察
取对照品储备液适量,用稀释剂定量稀释制成质量浓度分别为1、5、10、20、30、40、50、60 μg·mL−1的系列对照品溶液。取上述系列对照品溶液适量,按“2.5.1”项下色谱条件进样测定,记录峰面积。以质量浓度为横坐标、峰面积为纵坐标进行线性回归,得回归方程为y=31 290 x-4 394.1(r=0.999 7)。结果表明,吡罗昔康质量浓度与峰面积在1~60 μg·mL−1线性关系良好。
3.5.6 检测限和定量限考察
取对照品溶液适量,倍比稀释,注入液相色谱仪,按信噪比10∶1 确定定量限,信噪比为3∶1 确定检测限。经计算,吡罗昔康定量限为0.10 μg·mL−1,检测限为0.03 μg·mL−1。
3.5.7 稳定性考察
取样品溶液,分别在0、4、8、24h测定。吡罗昔康峰面积RSD均小于2.0%,说明溶液稳定性良好。
3.5.8 回收率考察
精密量取0.5 h 取样时间样品1 mL 置10mL 量瓶中,加入定量对照品储备液0.1、0.3、0.5mL,制成低、中、高3 个质量浓度加标供试品溶液,平行制备3份。取上述系列待测溶液适量,按色谱条件进样测定,记录峰面积并计算回收率。回收率为98.98%~101.88%,RSD均小于1.6%。
3.5.9 重复性考察
称取样品600 mg,置于10 mL量瓶,加稀释剂定容,平行配制6 份,分别进样,计算含量。样品含量的RSD为0.4%,表明该方法重复性良好。
3.6 建模及方法优化
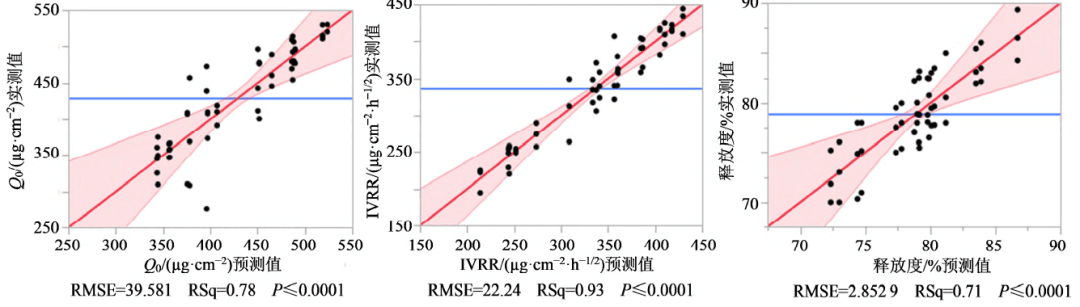
通过建模的方式评价CMV对CAA的影响及协同影响。利用JMP Pro 软件对实验结果(表4)进行建模分析,进行实验设计和多项式模型求解,对所建模型进行统计学检验。模型预测表达式见图3,表达式中的系数表明了CMV 对CVA 的影响程度,系数越大影响越大,系数为正表明有积极影响,系数为负,表明有消极影响。t 检验、方差分析表明所建模型合理,见图4。
为使IVRT 响应最大化,采用意愿函数对CMV进行优化,意愿函数越接近1,响应值越接近目标值。使用JMP Pro 进行预测值刻画,意愿函数最大为0.83,见图5,此时CMV为上样量为300 mg、释放介质为pH 7.2 的PBS、膜为MCE,该参数为最优参数。
3.7 IVRT方法学验证
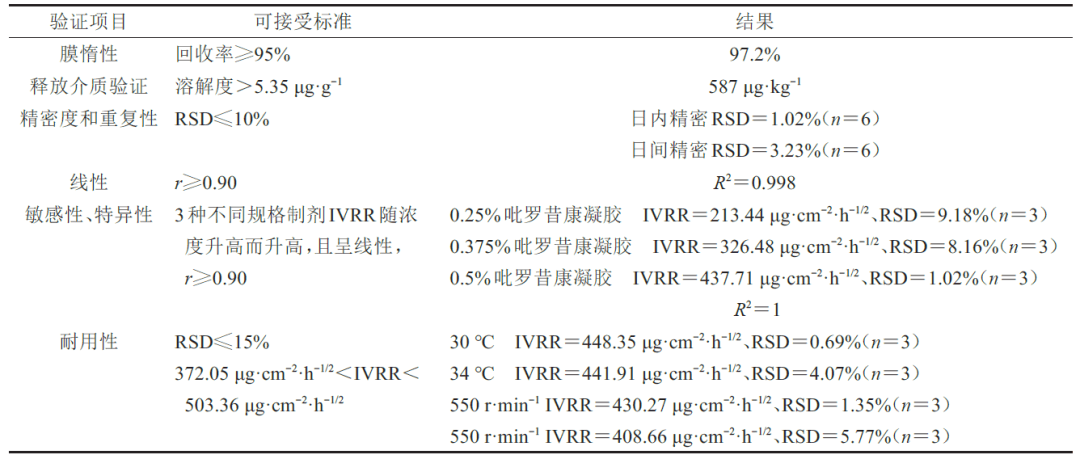
3.7.1 膜惰性验证
将MCE置于30 μg·mL−1 的对照品溶液中(32±1)℃ 、600 r·min−1 孵育6 h,重复3次,测定对照品溶液质量浓度前后变化,计算回收率。
3.7.2 释放介质验证
释放介质需要满足漏槽条件,测定pH 7.2 磷酸盐缓冲液中吡罗昔康饱和溶解度。
3.7.3 线性、精密度和重复性考察
连续3 d 进行3组IVRT 实验,每组6个,Q与√t 成线性,计算IVRR以表征IVRT方法的精密度和重现性。
3.7.4 敏感性和特异性
以市售吡罗昔康凝胶为原料,制备质量分数0.25%、0.375% 的吡罗昔康凝胶,进行IVRR 测定,评估IVRT 方法的敏感性和特异性。
3.7.5 耐用性考察
IVRT 温度为(32±2)℃,转速为(600±50)r·min−1时,考察方法的耐用性。IVRT方法学验证可接受标准及结果见表5。
4.1 CMV选择
吡罗昔康昔康凝胶属于无限剂量样品,上样量选择150、300 mg;0.9%氯化钠水溶液比较接近人体皮肤生理状态,人体皮肤表面呈弱酸性,因此选择0.9%氯化钠溶液、pH 5.5 磷酸盐缓冲液和pH 7.2磷酸盐缓冲液作为释放介质。不同膜结构性能不同,选择具有亲水性的MCE、PES 和具有疏水性的PTFE。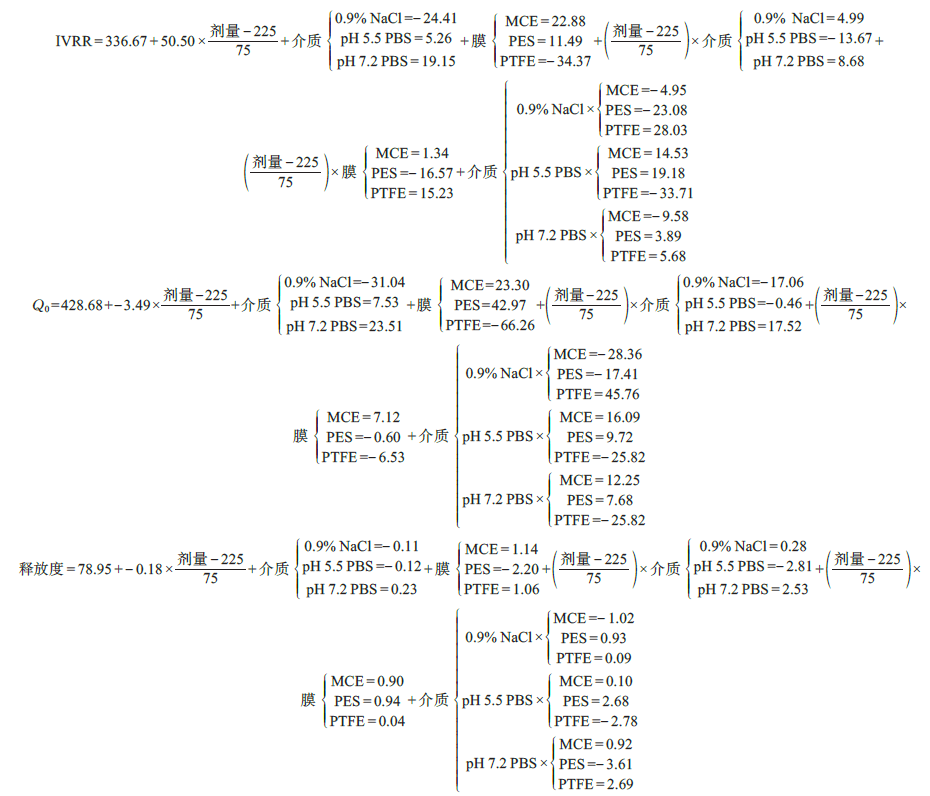
4.2 CAA分析
通过绘制Q与√t 的关系得到的回归线的斜率,即IVRR。IVRR 是IVRT 的CAA,也是评价半固体制剂质量一致性的重要工具之一。建模结果表明CMV中上样量对IVRR的影响最大,其次是膜和释放介质,膜与上样量、介质的交互影响作用显著,其余交互影响作用不显著。Q0为30 min 时累积释放量,旨在排除剂量倾倒的可能性,建模结果表明CMV 中膜、释放介质和膜与释放介质的交互影响具有显著性。释放度旨在评价释放过程中质量守恒,表达式中释放度的各项系数相对较小,表明该CAA受影响较小。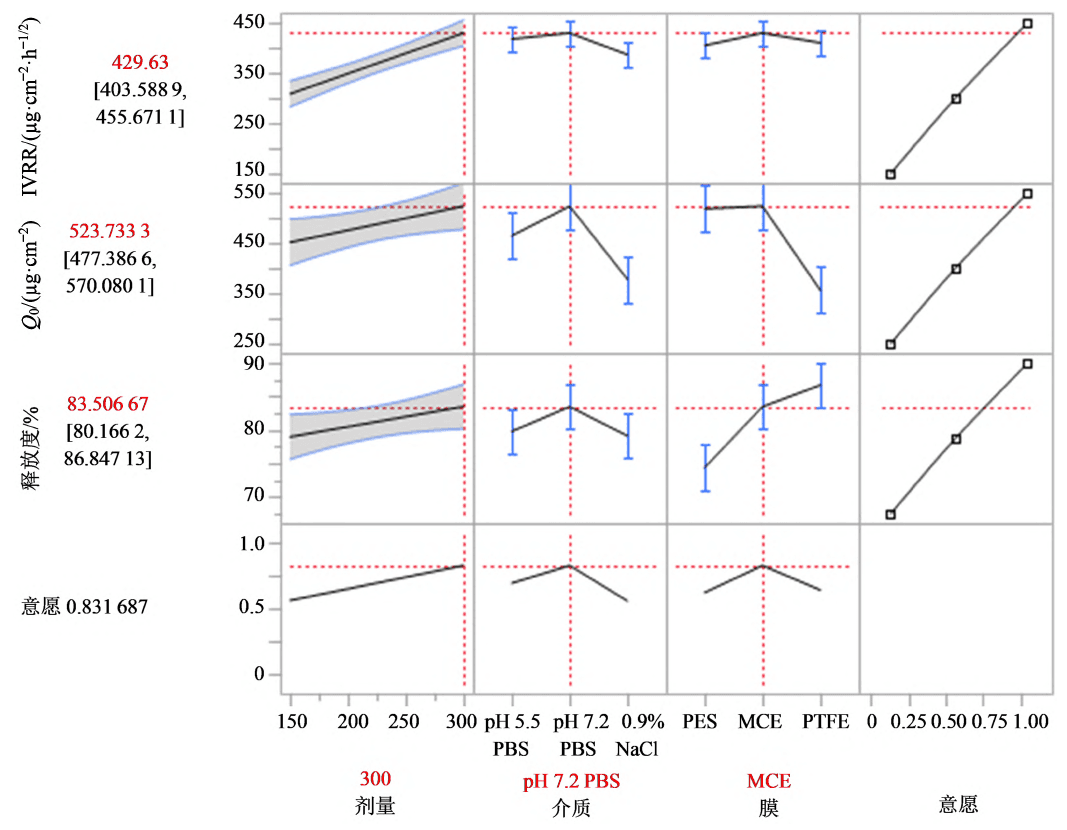
本研究以AQbD理念作为IVRT 方法开发的框架,从定义分析目标入手,确定CMA后,将IVRT 的影响因素进行全面剖析,并进行风险评估,确定CMV,采用2×3×3 全因子设计实验,评估上样量、膜的种类和释放介质对CAA(IVRR、Q0和释放度)的影响。对这些影响进行建模并通过t 检验和方差分析验证所建模型。利用所建模型的预测功能,得到IVRT 释放最大化的参数MCE、pH 7.2 磷酸盐缓冲液和300 mg 的上样量。根据欧洲和美国监管机构的最新指南,对优化后的IVRT 条件进行了膜惰性、线性、精度、耐用性性和区分力指标的评估,同时对HPLC法进行了验证,证明该方法可靠、耐用具有区分力。
略 如需原文,请联系小编(代老师15012941165)