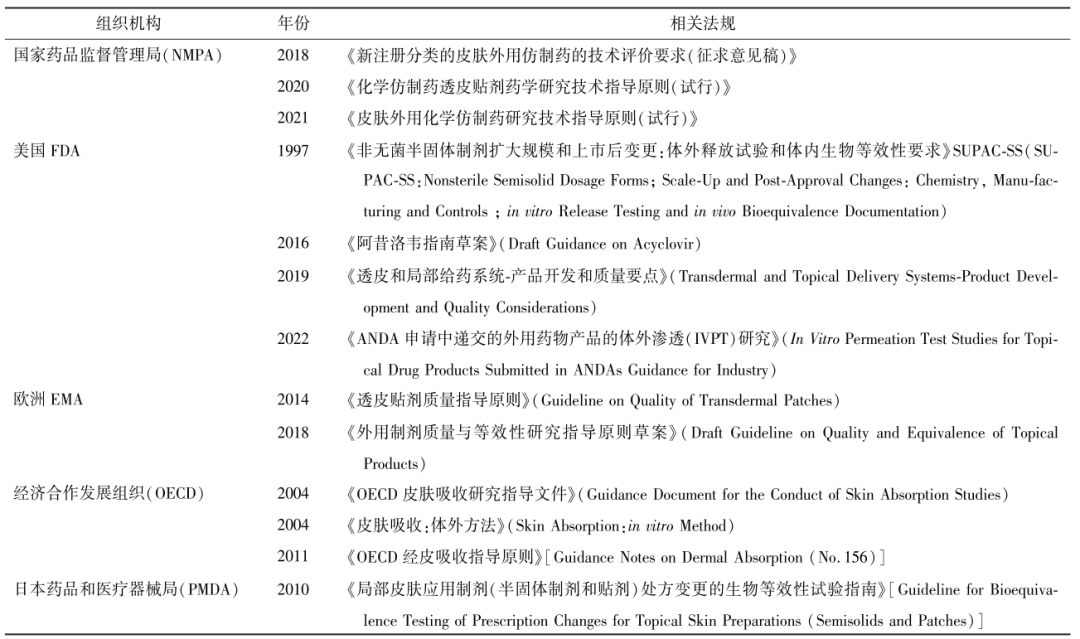
时间:

体外渗透试验(in vitro permeation test,IVPT) 作为最关键的体外研究项目之一,已被广泛用于皮肤递药制剂的研发及其生物等效性(bioequivalency,BE)评价。IVPT通过模拟药品在生理条件下的透皮过程,反映药品的质量与临床治疗的有效性,但在实际操作中存在皮肤难以获得,皮肤受种属、年龄、状态、部位等多因素干扰的困难。为了完善规范IVPT,国内外药品监管机构已制定了不同的试验标准。因此,本文参考国内外相关IVPT法规,结合文献研究内容,对IVPT的关键设计因素进行总结归纳,并补充了其作为评价手段的典型应用以供业界人士参考。

皮肤递药制剂通过皮肤途径给药,根据疗效可分为作用于皮肤局部起效的制剂和经皮吸收进入血液循环后起全身作用的制剂 。根据制剂剂型及组成形式,可以分为半固体制剂,包括软膏剂、乳膏、凝胶剂等,以及全身或局部递送的组合式经皮给药系统,(transdermal and topical delivery systems,TDS)主要包括透皮贴剂和贴膏剂。
皮肤递药制剂作为一类复杂制剂,处方组成或生产工艺的变化可能会显著影响药物有效性和安全性。为了对皮肤递药制剂进行更好质量研究和评审,针对局部起效的复杂制剂,需确定皮肤内制剂的药物浓度并分析其对真皮深层组织的渗透行为,以便评估真皮层的生物利用度(bioavailability,BA)或不同制剂之间的生物等效性(bioequivalency,BE)。然而建立皮肤外用制剂的BE,大多需进行临床疗效试验,需要大量人力和物力,昂贵且耗时 。目前为止已开发了不同的体内、体外测试方法用以证明局部外用制剂的BE。IVPT作为体外测试方法之一,通过评估皮肤外用局部制剂中药物(即活性成分)到达皮肤作用部位或附近的速率和程度,可与BE体内评估相关联并进行预测 ,在一定程度上表征和评估仿制药与参比制剂中药物的生物等效程度以及安全暴露程度。
为建立全身给药经皮制剂的BE,对于给药后存在一定全身性吸收的药物,可采用静脉采血法研究经皮给药后的药动学生物等效性(PK-BE)。IVPT作为一项有效的评价方法,可用于评价皮肤递药制剂中药物(即活性成分)经皮渗透并进入体内的行为,模拟药品在生理条件下的透皮过程,以部分地反映药品的质量与临床治疗的有效性,并在一定程度上预测药物体内吸收的过程,以及评估受试制剂与参比制剂的生物等效性差异。
IVPT主要利用人体或动物的离体皮肤进行实验,模拟外用制剂在生理条件下的透皮过程,通过测量药物透过皮肤的渗透速率和程度表征评估自研外用制剂与对照制剂中药物的BA。早期为证明体外试验模型替代BE检验的有效性,Franz等通过试验有力支持了体外人体皮肤模型的相关性和预测能力。相较临床终点研究,IVPT可使试验成本大大缩小,但在实际操作中存在皮肤难以获得,皮肤受种属、年龄、状态、部位等多因素干扰,皮肤处理困难,方法可重现性差等困难因素,进而影响结果的可靠性。为规范试验操作,各药品监管部门已发布相关指导原则(见表1),但至今仍没有统一标准,因此本文通过结合IVPT相关指南及国内外研究文献,对涉及IVPT关键技术参数的影响因素进行了归纳总结,并补充了其作为评价手段的典型应用。
2.1 皮肤类型
药物的透皮速率高度依赖于皮肤的类型和质量,离体人类皮肤被视为是最适合IVPT的模型(黄金标准)。但由于涉及伦理问题,多数国家未建有人体皮肤银行,皮肤通常难以获取。另一方面由于性别、种族、年龄和供体解剖部位的差异也常导致试验标准化水平较低。研究表明,相对离体人体皮肤,猪和豚鼠作为皮肤渗透性研究的模型往往具有更少的样本差异性 。目前各种哺乳动物、啮齿动物和爬行动物的动物皮肤模型已被开发为人类皮肤的替代品,在IVPT中进行广泛研究。同时人造皮肤由于结构和生理特征方面与人体皮肤相似,且不存在伦理问题,也已被开发为经皮渗透模型 。针对IVPT不同动物模型以及各种人造皮肤模型的优势及局限性可见表2和表3。


2.2 皮肤处理和储存
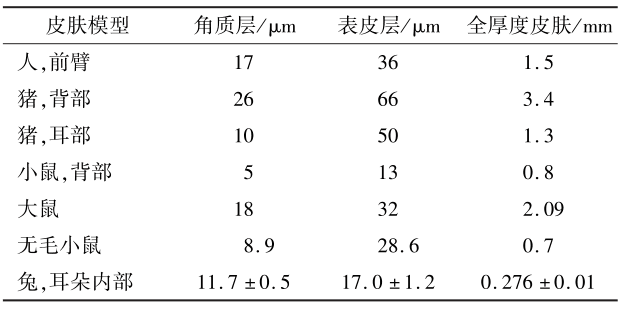
不同个体以及人体不同部位皮肤由于角质层厚度、脂类含量及组分的差异导致皮肤屏障功能不同,因此对药物的透皮吸收能力不同。沈腾等采用Valia Chine扩散池与HPLC法对比了男性和女性身体不同部位皮肤对川芎嗪渗透速率的差异,结果表明男性额头、耳后、胸部等5个部位的经皮渗透能力显著高于女性,且额头部位的皮肤对川芎嗪的渗透系数远高于对川芎嗪渗透速率最小的胸部皮肤。因此所有皮肤的使用来源以及皮肤供体中指定的解剖区域应保持一致,同时应排除有纹身等任何皮肤异常迹象或毛发浓密的皮肤。
皮肤在处理过程中很大可能会影响药物的经皮渗透性和滞后时间 。处理皮肤时,为避免破坏皮肤屏障,应采用温和的方式处理皮肤表面。为避免水合作用影响皮肤的渗透性,也不宜将皮肤浸泡在水溶液中。经处理完的皮肤膜通常有3种类型:表皮膜(厚度约0.1mm,可通过热分离、化学或酶法制备)、剥离一定厚度的皮肤(厚度为0.2~0.5mm)和全厚度皮肤(厚度为0.5~1.0mm)。全厚度皮肤通过去除结缔组织和皮下脂肪制备,由包括真皮在内的所有层组成,相对其他 2种类型的皮肤膜,皮刀控制全层皮肤的切割厚度在500~750μm,可减少测量值的变异性,适用于小鼠或兔等皮肤厚度较薄的动物模型以及亲水性化合物的体外研究 。但针对亲脂性较强的化合物,由于其经皮渗透性弱、滞后时间长,使用全厚皮肤可能会影响试验结果 。本文总结了IVPT中常用动物皮肤模型相对于人的皮肤层厚度,如表4所示。
皮肤在储存过程中,储存条件可能会破坏皮肤的屏障完整性,进而影响皮肤的渗透,因此最好使用新鲜切除的皮肤进行实验。针对动物皮肤模型,常采用新鲜处理过的皮肤,而新鲜离体人类皮肤不易获得,在使用前常需在-20℃的条件下冷冻保存 。针对冷冻储存对皮肤渗透性的具体影响,有研究发现,新鲜皮肤和经冷冻处理皮肤在透水性方面没有差异 ,但经冷冻的皮肤对其他化合物的渗透性增加,导致药物经皮滞后时间缩短 。然而Nicoli等发现经冷冻处理的兔耳皮肤对雌二醇的渗透性低于新鲜兔耳皮,作者将此归因于皮肤经冷冻后酶活性增加,导致雌二醇在透过皮肤时发生了酶促分解。冷冻可能会改变表皮内的细胞活力,因此不适用于研究药物在皮肤中的代谢活性。目前各监管机构之间尚未就皮肤在使用前的冷冻时间达成共识。国际化学品安全规划署(International Programme on Chemical Safety,IPCS)规定人体皮肤可以储存1年,而美国环境保护署(U.S Environmental Protection Agency,EPA)只允许皮肤储存3个月。同时皮肤经冷冻储存后,还需注意皮肤的解冻过程。与新鲜皮肤相比,冷冻皮肤未经水化前,其皮肤渗透值可能会发生改变 ,因此在使用前应适当地给其补充水分。
2.3 皮肤完整性检查及供体数的确认
无论选择何种皮肤,在实验前后均需对皮肤的屏障完整性进行测试,以鉴定研究中给药的每个皮肤切片的有效性。针对皮肤屏障完整性测试方法,尽管还没有相应的药典收载或法定可接受标准,但目前常见的有3种方法,即经皮水分散失法(trans-epidermal water loss,TEWL)、氚化水渗透法(tritiated water)和经皮电阻法,(trans-epidermal electrical resist-ance,TEER)表5对3种测试皮肤屏障完整性的方法进行了总结归纳。

TEWL通过测定皮肤外表面附近的水分(蒸汽),评估水分从皮肤下侧通过皮肤屏障的速率评估皮肤的屏障完整性,因技术成熟、操作方便而被广泛接受。但TEWL测量值常可能因TEWL测试设备、操作方式和环境条件的不同而变化。为了避免测试环境中的空气流动对测量值的影响,在测试设备上建议选择封闭式腔室 。针对开放式腔室,则需要导流罩消除空气流动的影响 。关于TEWL用于评估皮肤屏障完整性的截止标准, Zhang等在研究TEWL与模型药物芬太尼透皮贴剂经皮渗透之间的关系中指出,当皮肤样本数量较少时,TEWL值为10g·m-2 ·h-1可作为屏障完整性的测试标准。美国FDA对TEWL测试的可接受标准则为15g·m-2 ·h-1 。
在氚化水渗透试验中,在扩散池供体室中加入少量氚水,根据皮肤对氚化水的渗透性测试皮肤的完整性。早期根据Franz等 的研究,30min内氚化水的经皮渗透值超过1.6μL·cm-2的皮肤样本则会被认为屏障受损,不予使用。随后根据其他实验室经大量测试产生的结果分析,还提出了1.56和2.0μL·cm-2 。
TEER测试是通过在皮肤样本上施加少量离子溶液测得的电阻值来表征通过皮肤的电流量。相比其他2种测试方法,TEER可快速评估皮肤的屏障完整性。关于测试皮肤屏障完整性的截止标准,可通过试验数据证明。然而,TEER的测试结果仍受设备、应用频率、溶液离子强度、温度和皮肤表面积等因素的影响,且不同动物模型的皮肤样本也可能影响TEER结果,因此不同文献报告的测量值并不一致,可用的数据仍然受限。本文选取了部分文献中所报告的TEER测量值用于参考,详见表6。

由于人体皮肤个体间和个体内存在可变性和差异性,因此需根据实际需要确认皮肤的供体数和重复数以验证对IVPT方法的标准化和可重复性,关于各监管机构对其详细的说明可参考IVPT中皮肤设计需考虑的要点总结(见表 7)。

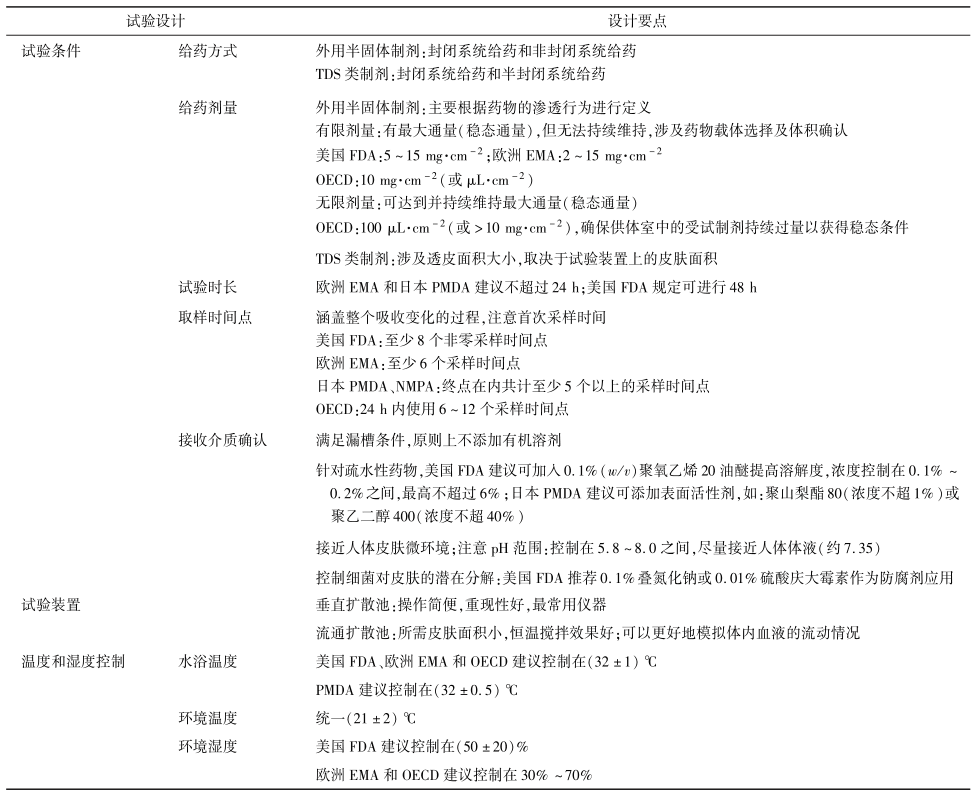
各监管机构对试验设计方面做出的具体要求不同,试验前需根据制剂种类和药理作用,设计合理的实验方案。表8总结了IVPT中常见的试验设计要点。
3.1 试验条件
3.1.1 给药方式
针对皮肤外用的半固体制剂,常见的IVPT有封闭系统试验和非封闭系统试验。由于封闭系统通常会导致皮肤逐渐水化,使角质层的渗透性增加 ,因此在IVPT研究中大多进行非封闭试验以模拟药物经皮渗透的真实情况。相反,当被测物含挥发性成分时,为确保试验的准确性以及模拟真实的临床情况,应采用封闭系统给药。Jung等使用乙醇作为载体研究儿茶酚的经皮吸收,结果表明封闭条件下皮肤可渗透的应用剂量为78%,而非封闭条件下只能渗透55%的应用剂量。
针对TDS类制剂(透皮贴剂、贴膏剂),根据背衬材料的透气性,IVPT给药方式可分为封闭系统给药和半封闭系统给药。背衬材料特性的不同决定了氧气和水蒸气的透过性不同,从而影响了皮肤的水合程度,甚至可能影响药物的释放 。常见背衬层材料有聚酯⁃聚乙烯复合膜、聚酯⁃铝⁃聚乙烯复合膜、聚酯无纺布、聚酯弹力布等。相较而言,一些膜材如聚酯膜以及聚酯⁃铝⁃聚乙烯复合膜的阻隔性较好,作为封闭性背衬材料,制备的TDS类产品(特别是全身给药的透皮贴剂)贴附在皮肤上,透湿性低,造成皮肤水合程度高,有利于药物穿透皮肤;而具弹性的聚酯类无纺布、聚酯弹力布等对氧气和水蒸气的透过性相对于封闭性的背衬材料更强,该类产品贴附在皮肤上,透湿性更高;同时不同于局部半固体制剂的完全开放状态,其又具有一定的封闭性,因此在IVPT中一般作为半封闭系统进行试验。
3.1.2 给药剂量
针对外用半固体制剂,离体皮肤的给药剂量可分为无限剂量和有限剂量。无限剂量是指在达到并维持受试物质(每单位皮肤面积)最大吸收率的情况下,涂抹在皮肤上受试制剂的量。因此应用于皮肤时,其溶液浓度不会随时间发生显著变化,在试验中可以达到并维持最大通量(稳态通量)。然而,在非封闭条件下给予皮肤有限剂量后,被测物的量会随着时间的推移而减少,可达到最大通量但无法持续维持。有限剂量的确定涉及药物载体的选择及体积的确认。给药剂量过多可能导致皮肤水化或破坏屏障完整性。当给药剂量较小时,需关注载体的表面润湿性、黏度和密度等因素,考虑制剂能否均匀地覆盖在皮肤表面。无限剂量的确定则需认真考虑用于计算通量和表观渗透系数的稳态条件。
而针对TDS类制剂,目前没有指导原则明确规定其给药剂量。在IVPT研究中,透皮贴剂的给药剂量涉及透皮面积大小,被裁剪面积通常取决于试验装置上的皮肤面积,需保证透皮贴剂能完整覆盖在皮肤表面。
3.1.3 试验时长和取样时间点
试验时长和取样时间点一般与目标化合物的性质及制剂处方的特性相关。采样时间点作为实验参数,其数量应能涵盖整个吸收变化的过程以完整描述动力学吸收曲线。具体的采样频率需根据测试物质的预期皮肤渗透率来定义,被测物的渗透速度越快,采样点之间的时间间隔就越短。首次采样的时间通常由被测物分析方法的检出限决定,采样点数量可能受分析成本等因素影响。因此,部分实验室可能根据以往经验判断采样频率,从而导致不一致的皮肤渗透特性。例如:研究金属体外渗透的第1个采样点通常设置为2h;而采用高灵敏度分析方法进行连续采样时,检测出金属的经皮渗透发生得更早,首次采样时间则需控制在试验开始后的2h内。
3.1.4接收介质确认
理想的接收介质应在满足漏槽条件的基础上尽可能接近人体皮肤微环境。在确定合适的接收介质时,应根据被测物质与皮肤的兼容性以及在接收介质中的稳定性和溶解度确定接收介质的组成和pH。目前国内外常用的接收介质有生理盐水、林格氏液、等渗磷酸盐缓冲液。对于非活性皮肤制剂,用于评估水溶性化合物的接受介质通常为pH7.4的磷酸盐缓冲液;而脂溶性化合物一般难溶于生理盐水和磷酸盐缓冲液,需要加入添加剂改善药物溶解性。
通常有机溶剂会改变角质层中细胞间脂质的结构进而增加皮肤渗透性,因此原则上在IVPT接收介质中不建议添加有机溶剂。为保证漏槽条件,针对疏水性药物,美国FDA建议可在基于生理缓冲盐的接收介质中添加 0.1%聚氧乙烯20油醚提高溶解度;日本PMDA则建议可添加对皮肤影响较小的表面活性剂以提高药物溶解度,并推荐使用聚山梨酯80(Tween80)或聚乙二醇400(PEG400),但需控制浓度范围。研究发现,1%Tween80溶液不会对 药 物 的 透 皮 吸 收 产 生 明 显 影 响,但 以PEG400作为接受液时,其体积分数宜控制在20%以下 。
对于具有代谢活性的皮肤制剂,可使用基于生理的接收介质,如RPMI组织培养基或林格氏液。林格氏液作为接收介质,在支持皮肤活力方面相当于细胞培养基。RPMI培养基通常可使皮肤保持24h以上的新陈代谢活性并维持皮肤正常的生理渗透压。Gaucher等通过试验表明,相较林格氏液,皮肤在RPMI中可保留更大活力。
确定接收介质的pH值在试验中也至关重要。正常皮肤表面的pH有助于调节表皮屏障稳态,并维持皮肤微生物菌群平衡 。在IVPT研究中,接收介质的pH值应尽量接近人体体液(约7.35并具有足够的缓冲能力中和皮肤代谢产生的乳酸以维持皮肤正常的代谢活动。根据药5.8~8.0内。
为了减轻扩散池中细菌对皮肤的潜在分解,可加入一些不与药物发生相互作用且不影响药物渗透性的防腐剂,如 PEG400、叠氮化钠或庆大霉素等。美国FDA建议可加入约0.1% 叠氮化钠或0.01%硫酸庆大霉素作为IVPT的防腐剂。在一些时长为24h的研究中,叠氮化钠可用于长期渗透测定,但毒性较大,且对皮肤结构有破坏性,相较而言, PEG400和硫酸庆大霉素毒性较小 。
3.2 试验装置
IVPT的装置有垂直扩散池(推荐使用华溶TD-12AT PLUS 透皮扩散系统)和流通扩散池(推荐使用华溶DS-7CP PLUS 流池法溶出系统)。为了最大限度地减少对被测物质的干扰,扩散池通常由许多化学性质稳定的惰性材料制成,如玻璃、特氟龙等 。垂直扩散池最早是基于Franz提出的设计,后期由Keshary等在其基础上进行改进。由于操作简便、重现性好,已成为体外透皮扩散研究中最常用的仪器,用于评估皮肤渗透性、检查活性成分和制剂的关系以及反映外用制剂经皮透过的真实情况。流通式扩散池所需皮肤面积小、恒温搅拌效果好,适用于较长时间的皮肤渗透研究。同时流通池具有连续流动的接收液,可以更好地模拟体内血液的流动情况,因此,当需要对亲脂性化合物经皮渗透进行更多与生理相关的评估时,应优先考虑流通式扩散池 。
3.3 温度和湿度控制
IVPT中,接受介质作为离体皮肤的微环境,水浴温度过高不仅导致皮肤通透性增加,还会增大药物的溶解度。Kilo等发现,亲脂性化合物(苯甲醚)和亲水性物质(1,4-二恶烷、乙醇)的皮肤渗透行为均呈现温度依赖性变化。当皮肤暴露3h后,随温度升高,皮肤累积透过量最高可达原来的3倍。
在研究期间,还应对实验室的湿度进行监控和报告。环境湿度过高可能导致皮肤样品的角质层水合作用增强,进而影响体外皮肤渗透性。为了验证IVPT中湿度水平对皮肤渗透性的影响,Ishida等通过比较尼古丁透皮贴剂在临床湿度水平(约50%)和过高湿度水平(约95%)下的体外皮肤渗透性,发现药物在95%湿度下的皮肤渗透值显著高于50%湿度下的值。
IVPT影响因素众多,样本间变异性大,为了减少潜在的试验偏差来源,在 IVPT的初步研究和最终的正式研究中,需进行方法验证。IVPT实施成功的标志之一就在于其能否区分不同的制剂产品 ,因此便涉及区分力的验证。对IVPT区分力的评估包括灵敏度和选择性的验证。通过对灵敏度的研究可确定上样量和剂量维持时间等方法参数,进而检测药物皮肤药动学(PK)变化的能力以反映药物递送差异。IVPT的选择性则是指 IVPT方法区分“对照制剂”和“与对照制剂在药物递送方面存在差异的外用制剂或配方”药物在皮肤PK差异的能力。关于灵敏度的验证,美国FDA有3种方式:① 对于含有挥发性成分的外用制剂,可通过调整上样量以改变药物递送行为支持方法的灵敏度。② 可通过调整剂量维持时间来有效评估药物递送的差异和与药物皮肤PK相关的变化。③针对同一制剂,还可以调整产品规格,用高、中、低3种不同的规格评估方法灵敏度。但通常情况下,第3种验证方式可能不会按预期那样持续产生药物递送增加或降低的结果,因此,美国FDA不建议用此方法去论证IVPT的灵敏度。欧洲EMA 推荐用受试制剂50%的规格和参比制剂评估方法的灵敏度。对于选择性的验证,美国FDA和欧洲EMA均建议将对照制剂、自研外用制剂和“已知不同于对照制剂”的第3种外用制剂进行评估,提供支持性证据说明IVPT方法对药物递送的差异具有选择性。日本PMDA关于区分性的评估则没有相关规定。
IVPT研究的皮肤PK终点是基于表征药物渗透和通过皮肤进入接收液的速率和程度的参数。药物的渗透速率常采用单位面积渗透速率(Flux或J)进行表征,而药物的渗透程度采用单位面积药物累积渗透量(A)进行表征。目前,各组织机构关于IVPT数据处理的等效判定不同:美国FDA和欧洲(Atotal)作为评价指标,NMPA和日本PMDA关于IVPT的等效判定依据则为试验制剂与参比制剂的平均稳态渗透速率(Jss)之比,其进行了详细对比总结见表9。
IVPT研究的皮肤PK终点是基于表征药物渗透和通过皮肤进入接收液的速率和程度的参数。药物的渗透速率常采用单位面积渗透速率(Flux 或J)进行表征,而药物的渗透程度采用单位面积药物累积渗透量(A)进行表征。目前,各组织机构关于IVPT数据处理的等效判定不同:美国FDA 和欧洲EMA主要采用最大吸收速率(Jmax) 和累积释放总量(Atotal)作为评价指标,NMPA 和日本PMDA 关于IVPT的等效判定依据则为试验制剂与参比制剂的平均稳态渗透速率(Jss)之比,其进行了详细对比总结见表9。
j:药物通量,表示药物渗透速率,即单位面积药物透过皮肤的速率(g.com-2 ·h -1 );Jmax:药物最大渗透速率;Jss:平均稳态渗透速率;A:单位面积药物的累积渗透量(g.com-2 ),表示药物的渗透程度;Atotal:整个研究期间单位面积药物累积释放总量;tmax:药物渗透速率达到最大时所需时间;Tg为滞后时间;Stotal:皮肤组织中保留的药物的总量;Rtotal:残留在皮肤或试验设备上的药物总量;《新注册分类的皮肤外用仿制药的技术评价要求(征求意见稿)》在附件2针对IVPT数据处理的参数报告要求和日本PMDA 的指导原则一致;《皮肤外用化学仿制药研究技术指导原则(试行)》、《化学仿制药透皮贴剂药学研究技术指导原则(试行)》针对数据处理的参数报告要求,未进行具体规定
6.1 支持局部外用制剂的药学变更
IVPT作为评估局部外用制剂BE的替代方法,可通过评价定性(Q1)、定量(Q2)变化对经皮渗透的影响,进而支持该制剂风险等级的变更。盐酸布替萘芬乳膏(Lotrimin Ultra®,1%)作为一种外用抗真菌剂,原配方中含0.3%(w/w)二乙醇胺(DEA)充当pH调节剂。作为一种碱化成分,DEA已被FDA批准为非活性成分,但此成分经研究表明可能有致癌的风险。该产品配方经变更后,以 0.43%(w/w)三乙醇胺(TEA)代替了DEA。同样作为碱化成分,TEA具有与DEA相似的结构和理化特性。为证明制剂变更前后的BE,Mitra等以人体皮肤进行IVPT研究,用于评估该配方变化对盐酸布替萘芬经皮肤吸收的影响。对结果进行统计分析表明,当前配方和新配方中,盐酸布替萘芬的体外皮肤沉积和渗透方面没有显著差异,进而证明了配方变化对盐酸布替萘芬乳膏的皮肤渗透没有任何显著影响。目前该研究结果已被美国FDA接受,并被授权上市了新的Lotrimin Ultra® 乳膏。
6.2 作为支持局部皮肤科药物BE证明的敏感工具
皮肤外用产品仿制药的开发通常依赖于比较临床终点BE研究,为了减少试验成本,可选用体外试验模型替代BE检验。目前IVPT已被广泛用于表征应用于皮肤化合物的BA,有望与BE的体内评估相关联并进行预测 。阿昔洛韦乳膏(Zovirax®5%)作为一种外用抗病毒药,在比较临床终点研究的可行性方面一直暂未确定,因此在美国还没有经批准的仿制药,可作为模型药物代表许多局部皮肤科药物产品。Shin等 通过比较不同配方组成的阿昔洛韦乳膏(5%,w/w)与美国的参比制剂来评估 IVPT作为支持局部皮肤科药物产品BE证明的灵敏工具的有效性。通过对试验结果进行统计分析,表明IVPT作为一种灵敏且有鉴别力的测试方法,可检测不同配方的阿昔洛韦乳膏在皮肤中BE的速率和程度的差异。
6.3 体内外相关性(in vitro-in vivo correlation,IVIVC)的预测与评价
随着高质量仿制药的逐渐开发,美国FDA曾在文件中指出,体外研究证明IVIVC是确定BE最准确、最灵敏和最可重复性的方法之一。作为常见的体外研究模型,当IVPT和体内研究设计协调一致时,IVPT可预测体内BA,其试验结果可与体内观察到的BA数据密切相关。通常IVIVC的开发需要体内PK信息,以及同一经皮给药系统(transder-mal drug delivery system,TDDs)产品至少3个级别的递送速率。目前市售的雌二醇TDDs有多种药物递送率 ,因此可被开发为透皮产品的IVIVC模型药物产品。Yang等首次尝试使用市售的雌二醇开发IVIVC模型发现,人体皮肤的体外渗透百分比与雌二醇的体内吸收百分比之间存在很强的相关性。雌二醇TDDs构建的IVIVC模型可通过体外渗透预测体内血清药物浓度。该模型已通过了内部和外部验证,符合美国FDA 对IVIVC的建立标准。而Shin等则通过IVPT和体内人血清PK协调研究评估不同尼古丁TDDs中尼古丁BA的潜在IVIVC。结果也表明通过IVPT计算的预测血清中尼古丁浓度与在受试者中观察到的体内血清中尼古丁浓度之间存在较强的IVIVC。
6.4 评估热效应对经皮给药系统中药物渗透速度和程度的影响
当皮肤外部被施加热量或持续暴露于高温下时,可通过增加皮肤和外周血管的通透性加快TDDs的药物释放速度来增强药物释放 ,进而有可能导致皮肤内透过的药物过量。通常为使TDDs在使用期间能够维持恒定的药物释放速率,TDDs产品常被设计为含有过量的药物。在高温的影响下其药物释放速率极有可能发生变化,使体循环中的药物浓度显著升高的可能性大大增加。芬太尼作为一种毒麻药品,过量使用则会危及生命安全,因此美国FDA已发布了关于芬太尼TDDs经加热或暴露于高温下会产生威胁生命的不良反应警告 。
目前试验人员已经进行了大量研究阐明热量对皮肤外用产品在体内和体外性能的影响,IVPT便是评价TDDs热效应的常用模型之一。Zhang等便以芬太尼为模型药物,通过3种不同的芬太尼TDDs产品,确定可影响TDDs热效应评价的IVPT实验条件并重点研究了高温条件下IVPT对TDDs中药物渗透的影响。结果表明,当温度从32 ℃升高到42℃时,芬太尼TDDs的渗透通量增加了2倍,与使用芬太尼水溶液测定芬太尼的皮肤渗透活化能一致。该团队同时开发了一种使用外部加热灯的热应用方法评估热效应对尼古丁TDDs皮肤渗透的影响,结果同样表明在尼古丁TDDs的IVPT研究中,不同热应用方案的模型预测与相应的实验数据基本保持一致 。
IVPT作为皮肤递药制剂中代替等效性临床试验的有效方法,通过评估药物经人离体皮肤的体外吸收动力学来支持与参照药物相比的治疗等效性,可用于筛选药物制剂、评价制剂载体系统促进皮肤渗透的性质和作用机制以及通过预测药物分子的皮肤转运评估皮肤接触化学品的系统性风险。针对涉及试验关键技术参数的影响因素,本文结合不同监管部门发布的IVPT指南及国内外文献进行了归纳总结,包括皮肤、试验设计、方法验证和数据处理,同时补充了IVPT作为评价手段的部分典型案例说明其具体应用供相关人员进行参考。
IVPT目前已应用广泛,随着指导原则的颁布及国内外相关文献的发表,IVPT的试验技术日趋成熟,操作也在逐渐规范,但仍存在一些问题需要重点关注。首先,针对的应该是皮肤来源。皮肤在试验中对结果可靠性的影响巨大,一方面针对不同供应商,应如何建立统一皮肤标准;另一方面涉及皮肤银行问题以及后续应如何对皮肤进行处理,还需要行业间进行更多地交流以共同推进行业标准的建立,完善规范IVPT。其次,应如何对数据进行合理地统计处理以及证明IVPT与体内的相关性也是需要解决的难点。为了验证体外试验的IVIVC,研究人员进行了大量体外实验去模拟真实的生理条件 。但目前为止,针对半固体外用制剂,没有任何公开文件表明为已上市的产品建立IVIVC方法指南,大多研究者是参考美国FDA发布的关于口服缓释制剂IVIVC标准。由于口服缓释制剂在体外溶解的过程不可能模拟药物通过人体表皮渗透的复杂机制,因此目前研究透皮给药系统的IVIVC只能参考A级相关性。而体外条件与真实生理条件始终存有较大差异,怎样证明不同模型的IVIVC以及建立合适的IVPT模型去准确测定产品经皮渗透性并反映药物的有效性,还需继续研究探索。
略
如需原文,请联系小编(代老师15012941165)