时间:

作者:邹倩、赵春杰、邱宏春 郭晓迪
摘要
目的 建立一种依匹哌唑原位凝胶植入剂的体外释放方法,研究处方在体外的释放行为和缓释机制。
方法 以抗精神病依匹哌唑为模型药物,制备以聚乳酸⁃羟基乙酸共聚物( polylactide gly⁃ colic acid,PLGA)/醋酸异丁酸蔗糖酯( sucrose acetate isobutyrate,SAIB)为基质的原位凝胶植入剂。开发体外释放检测方法,采用多种体外释放装置研究依匹哌唑原位凝胶植入剂的释放差异, 考察体外释放的影响因素。
结果 依匹哌唑在酯基封端PLGA/SAIB处方下显示出低突释和释放缓慢的特征,体外释放以扩散为主,符合0级释放模型。采用分层加样的流通池法,药物在14d可达到完全释放,释放率达(85. 4 ± 2. 4)% 。
结论 依匹哌唑原位凝胶植入剂适合采用流通池法进行体外评价,建立的体外释放方法操作简便、可靠。同时处方在体外表现出明显的缓释效果,且释放稳定。
关 键 词

一、简 介
精神分裂症和重度抑郁症(major depressive disorder,MDD)是常见的严重精神类疾病,全球患病率约为1%。依匹哌唑(brexpiprazole)是第二代抗精神分裂症药物,用于成人精神分裂症与MDD的辅助治疗,主要作用机制是部分阻断多巴胺D2受体和5⁃羟色胺受体(5⁃HT1A),拮抗5⁃HT2A和去肾上腺素能α1/2受体。FDA于2015年7月批准依匹哌唑片(商品名:Rexulti®)上市,每日口服一次。通常精神类疾病需要长期治疗,目前已上市的抗精神病长效注射剂最长可实现6个月注射一次,在临床上受到了患者和医生的广泛青睐,依匹哌唑目前暂无长效注射剂上市。国内外针对依匹哌唑开发的长效制剂技术包括混悬液、原位相变凝胶注射剂 、磷脂原位凝胶和微球,开发持续缓释的依匹哌唑长效制剂将具有广阔的应用和商业价值。原位凝胶植入剂(in situ gel forming implant,ISGFI)是将可生物降解的载体材料溶解于具有生物相容性的溶剂中,并与药物混合,形成溶液或混悬液的一种新型缓释注射剂。在注入肌肉或皮下后,处方在注射部位发生相转变,形成由药物和可生物降解材料组成的固体植入体,持续释放药物可达数天或数月。其中原位沉淀系统(聚合物沉淀和蔗糖酯沉淀系统)由于其具有辅料少、处方工艺简单的优点而备受医药行业的青睐。本文作者拟制备依匹哌唑的原位沉淀系统制剂,在前期研究中发现醋酸异丁酸蔗糖酯( sucrose acetate isobutyrate, SAIB)/N⁃甲基吡咯烷酮(1⁃methyl⁃2⁃pyrrolidi⁃ none,NMP)基质处方在体外固化形成的贮库胶 凝强度较弱,体内和体外均表现出较高的突释,突释(24h)是原位凝胶制剂面临的主要风险,短时间血药浓度的升高,可能造成局部或全身的毒性反应。而处方中加入适当聚乳酸⁃羟基乙酸共聚物( polylactide glycolic acid,PLGA)后可有效降低体外突释且SAIB与低分子量PLGA相容性良好,有研究报道,采用PLGA/SAIB作为基质用于原位凝胶植入剂的开发。
体外释放方法是制剂质量控制的重要指标,可用于预测和评价产品在体内释放,减少体内(人体和动物)实验次数,大大降低药物研发的成本。由于原位凝胶注射剂缺乏成熟的体内体外相关性模型,体外释放方法的开发受限。主要存在的困难有:无标准化方法指导;胶凝形成植入物的形状差异;体外无法完全释放(>80% );释放方法操作时间过长等。这些困难使得原位凝胶制剂的开发和仿制药研发面临巨大挑战。本文作者以依匹哌唑为模型药物,制备PLGA/SAIB为载体材料的原位凝胶植入剂,首先采用多种非胃肠道制剂常用的体外释放方法 (透析法、桨法、摇瓶法、流通池法),从方法可操作性和释放差异来评估其适用性。其次,制备不同PLGA型号(L/G比,封端)、不同溶剂的处方,考察制剂的影响因素和释放机制,为进一步的体内研究提供数据支持。
二、仪器与材料
XS105DU型电子分析天平(瑞士 Mettler To⁃ ledo公司),Agilent 1260高效液相色谱仪(配有DAD检测器,美国Agilent公司),全自动流通池法溶出度测试系统(推荐使用华溶仪器DS-7CP PLUS 流池法溶出系统),溶出自动取样系统(推荐使用华溶仪器DS-1406AT全自动取样溶出系统),Nanopure纯水仪( 美 国 Thermo Fisher Scientific公司)。
依匹哌唑原料药(含量质量分数100.2% ,浙江华海药业股份有限公司),N⁃甲基吡咯烷酮(1⁃ methyl⁃2⁃pyrrolidinone,NMP,上海阿拉丁试剂有限公司),PLGA(德国赢创 EVONIK 公司,50∶ 50羧基封端PLGA502H:分子量分布7~17kDa;50∶ 50 酯 基封端 PLGA502:分子量分布7~17kDa;75∶25羧基封端PLGA752H:分子量分布4~15kDa),乙酸异丁酸蔗糖酯(sucrose acetateisobutyrate,SAIB,美国Eastman公司),三醋酸甘油酯(triacetin,TA,美国J. T Baker 公司),苯甲酸苄酯(benzyl benzoate,BB,上海阿拉丁试剂有限公司),苯甲醇(benzyl alcohol,BA,德国 Merck 公司),十六烷基三甲基溴化铵( cetyl ammoniumbromide,CTAB,上海阿达玛斯试剂有限公司),十二烷基磺酸钠(sodium dodecyl sulfate,SDS,美国Sigma 公司),聚乙二醇辛基苯基醚( Triton X⁃ 100,上海沪试实验室器材股份有限公司),氯化镁(上海阿达玛斯试剂有限公司),氯化钠(上海沪试实验室器材股份有限公司),氯化钾、氯化钙、二水合磷酸氢二钠、磷酸二氢钾、葡萄糖、碳酸氢钠(上海泰坦科技股份有限公司),硫酸镁、磷酸、乙腈、甲醇(美国Sigma公司)。
三、方法与结果
3.1 处方制备
3.1.1 释放方法筛选
制备质量比为50∶ 50的SAIB⁃NMP基质,在振荡仪上室温振摇过夜,使其完全溶解,形成澄清透明均一的溶液。称量上述溶液和质量比10%的PLGA502H于西林瓶中,磁力搅拌约30min使其完全溶解,再加入处方量的依匹哌唑原料药(载药量:10mg·g -1),搅拌至完全混匀,置于2~8 ℃备用。
3.1.2 处方释放的影响因素考察
称取处方量的SAIB,加入NMP或DMSO作为溶剂,放置于振荡器上室温过夜振摇使其完全混匀,形成澄清透明均一的溶液。按表1,称量SAIB⁃溶剂基质、PLGA(不同封端和不同L/G比)和0、10% 、20% 释放调节剂(三醋酸甘油酯和 苯甲酸苄酯)于西林瓶中,用磁力搅拌约30min使其完全溶解,再加入处方量的依匹哌唑原料药(载药量:10mg·g),搅拌至完全混匀,置于2~8 ℃备用。
表1 原位凝胶植入剂处方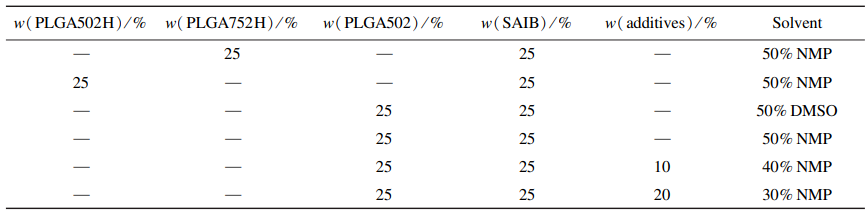
表2 吡罗昔康凝胶IVRT的CAA

3.2 体外释放检测方法的建立
3.2.1 色谱条件
色谱柱:Agilent Eclipse Plus(100mm×4. 6mm,3. 5μm)柱,流动相:pH6.8磷酸盐缓冲液(2. 8g磷酸氢二钠至1L超纯水,溶解混匀,用磷酸调节pH至6. 8,混匀,经0. 45μm微孔滤膜过滤)⁃乙腈(体积比45∶55),流速:1. 0mL·min,柱温:35℃,检测波长:215nm,进样体积:20μL,运行时间:6min。
3.2.2 溶媒
称量氯化钠8g、 氯化钾400mg、氯化钙140mg、七水合硫酸镁100mg、六水合氯化镁100mg、二水合磷酸氢二钠60mg、磷酸二氢钾60mg、葡萄糖1g、碳酸氢钠350mg和十六烷基三 甲基溴化铵1g于1L纯化水中,搅拌至完全溶解。
3.2.3 对照品溶液
称取适量依匹哌唑原料药,置于500mL量瓶中,用乙腈⁃水(体积比75∶25)超声溶解,定容,制成60μg·mL的依匹哌唑对照贮备液;移取适量对照品贮备液,用溶媒作为稀释液,稀释定容制成6μg·mL的对照品溶液。
3.2.4 方法学验证
空白溶媒、空白辅料(PLGA/SAIB/NMP 混 合基质)和样品溶液色谱图见图1,在依匹哌唑(保留时间约4. 0min)出峰处无明显干扰,方法专属性良好。以依匹哌唑峰面积(A)为纵坐标,样品质量浓度( ρ,μg·mL)为横坐标进行线性 回归,所得标准曲线方程为A=196. 6ρ+2. 001,r=1.000,线性范围为0. 3~12μg·mL,线性关系良好。准确度研究:0. 3、6、9μg·mL三个质量浓度水平的测得浓度和理论浓度比值分别为101. 4% 、100.5%和100.3%(n=3),RSD为2.8%(n=9),表明准确度良好,方法学验证结果均符合接受标准。
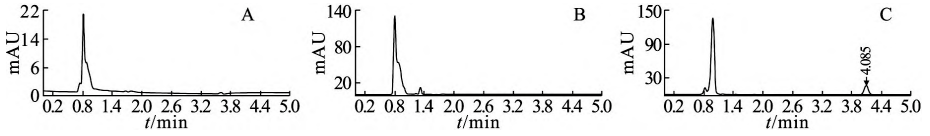
图1 空白溶媒(A)、空白辅料溶液(B)和样品溶液(C)的高效液相色谱图
3.3 释放介质的选择
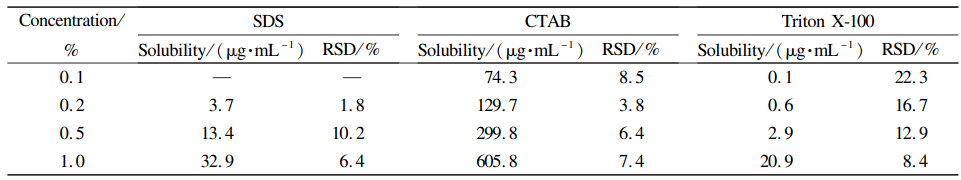
参考上市产品Perseris® ,Hank′s平衡盐溶液可以模拟人体皮下环境间质液的pH和离子组成。由于依匹哌唑原料药在Hank′s平衡盐溶液 中的饱和溶解度小于0.1μg·mL,为满足漏槽条件,考察了加入质量分数分别为0. 1% 、0.2%、0. 5%和1. 0%的不同种类表面活性剂的饱和溶解度(37 ℃ ),结果见表2,其中CTAB的增溶效果最明显。当介质中加入质量分数0. 1%CTAB(临界胶束浓度:0.033%~0.036%,来自USP)时,可满足漏槽条件,同时,CTAB具有一定的抑菌性,可防止长期运行而产生的微生物污染。最终选择溶媒为Hank′s平衡盐溶 液+0. 1%CTAB。另外,考察了依匹哌唑在37 ℃条件下的溶液稳定性,结果表明依匹哌唑原料药在溶媒中21d内稳定,回收率均在98. 0%~102.0% ,满足制剂长期释放要求。
表2 37 ℃下依匹哌唑在pH7. 4Hank′s平衡盐+不同表面活性剂中的饱和溶解度(n=3)
3.4 体外释放方法考察
原位凝胶植入剂常用体外释放方法有摇瓶法、透析法(正相、反相透析,综合透析法)、桨法(USP2 法)、流通池法(USP 4 法)等。由于原位凝胶植入剂的释放表面积的不同可能影响药物的释放,所以在前期研究中,采用综合透析法(D⁃ Tube TM Dialyzer Mini,截留分子量为12~14 kDa透析管+篮法)进行释放研究,将处方加入透析管中,再将透析管放入篮法中,把处方释放表面积控制在透析管膜上,结果发现处方释放非常缓慢(2d释放不到10% )且重复性差。推断的原因是透析膜对药物的扩散有阻碍,释放受到膜的限制;其次处方中含有SAIB,由于SAIB黏度较大,易黏附在透析膜上,阻挡管内外的介质交换,导致释放延迟,所以不适宜采用透析法。
3.4.1 摇瓶法
用1mL带21G针头注射器吸取0.1mL制剂处方,注入60mL溶媒,转速:75r·min-1,摇床温度:37 ℃,于设定的时间点取样2mL,经0. 45μmPVDF过滤后进行检测。
3.4.3 桨法
用1mL带21G针头注射器吸取0.1mL制剂处方,用注射器将处方从液面下打入900mL溶出杯中。转速:50r·min,温度:37 ℃,于设定时间 点取样2mL,经10μm在线过滤头和0.45μm PVDF滤膜过滤后测定,使用防挥发罩,注意溶媒挥发。
3.4.3 流通池法
闭环,流速:8mL·min,溶媒温度:37℃,溶酶体积:900mL,于设定时间点取样2mL,经2.7μm直径玻璃纤维过滤膜(GF/D,What⁃ manTM )和0.45μmPVDF过滤。加样方式A:向22.6mm制剂池底部加入1颗红宝石球,用直径1mm玻璃珠填充至样品池底部锥形部分,加入8mL溶媒,在液面下用1mL注射器(21G针头)注入0.1mL样品,铺在玻璃珠上层,待胶凝10min后开始运行。加样方式B(分层加样⁃上下 加玻璃珠):加样方式与前面步骤一致,在胶凝10min后在原位制剂上方再加入约9g玻璃珠后,运行程序。
3.4.4 统计分析
每批处方至少制备三份,计算不同时间点的平均累积释放率,为了对比同一时间点两个值之间差异的显著性,使用置信水平为95%的t检验,P<0.05被认为是具有显著性差异。采用Graph⁃ Pad Prism7软件进行统计分析。
3.4.5 体外释放方法比对
在SAIB⁃NMP= 50∶ 50(质量比)基质中加入 质量比为10%PLGA502H,考察三种常用体外释 放方法(摇瓶法、桨法和流通池法⁃加样方式A)的 释放差异。结果见图 2。
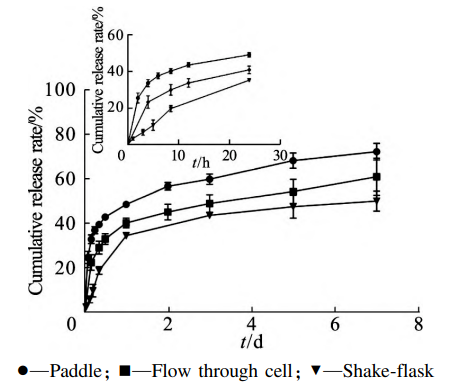
图2 不同释放方法体外释放曲线比对(x ± s,n = 3)
从图可知,三种方法的释放速度具有一定差异,桨法、流通池和摇瓶法7d累积释放率分别为(73. 01 ± 3. 78)% 、(61. 79 ± 8. 34)% 和(50. 86 ± 4. 48)% 。为研究处方的释药机制,对三种体外释放结果使用Origin Pro 8.0软件分别进行体外释放动力学模型拟合,包括:0级动力学方程、1级动力学方程、Higuchi方程,详见表3。
表 3 不同释放方法的体外释放拟合方程结果
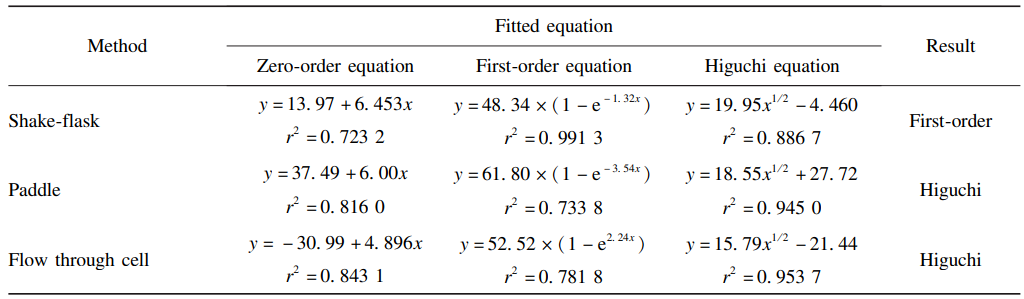
从拟合方程结果可以看出,摇瓶法结果符合1级释放模型,桨法和流通池法符合Higuchi方程。Higuchi方程为骨架扩散机制,是描述药物从基质释放的常用数学模型。以PLGA/SAIB/NMP基质的处方加入介质后,在发生相转变过程中药物随溶剂NMP扩散到介质中为突释阶段;1136沈阳药科大学学报第40卷然后PLGA遇水固化后形成被薄膜包围的多孔结构,当制剂表面或表层的药物释放完成后,深层的药物通过弯曲的孔道扩散出来;最后药物随聚合物溶蚀而释放,整个释药过程以扩散为主。Higuchi方程更符合该处方的体外释药特性。另外,摇瓶法在取样时发现凝胶制剂易受到破坏,导致制剂损失和结果重复性差。同时,原位凝胶植入剂释放时间较长(如14、30d 等),桨法装置下溶媒挥发,操作时间过长,可能导致释放结果的不准确且无法自动化取样的摇瓶法装置,会增加工作量。因此,本文作者采用流通池法对处方释放 影响因素的考察。
3. 5 依匹哌唑原位凝胶植入剂体外释放影响因素考察
3.5.1 不同PLGA类型对释放的影响
不同封端基团由于聚合物极性差异会表现出不同的释放行为 ,考察加入不同封端的PLGA(PLGA502H 和 PLGA502)和不同L/G 比例PL⁃ GA(75∶25,PLGA752H)处方的释放差异(图3)。
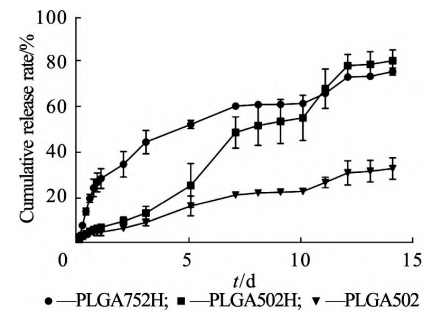
图3 不同PLGA类型对体外释放的影响(流通池法⁃加 样方式A,x ± s,n=3)
根据图3可以看出,不同PLGA型号⁃SAIB的混合基质处方体外释放差异较大。首先是突释,PLGA752H处方1d内的体外突释为(28. 3 ± 4. 4)% , 与 PLGA502[( 4. 4 ± 1. 6 )% ]和PL⁃ GA502H[(6. 5 ± 1. 2 )% ]相比,具有明显差异 (P<0. 05),而不同封端PLGA的处方突释无明 显差异。从第5天起,以羧基封端处方释放明显 快于酯基封端,14d释放分别约(80. 6 ± 4. 9)%和(32. 7 ± 4. 8)% 。PLGA 502以酯基封端,极性 较低,亲水性弱,依匹哌唑为BCS II类的亲酯性 药物,与聚合物的亲和力较溶剂更强,体外释放缓 慢,比羧基封端表现出更长的缓释效果。另外,通 过与0级、1级和Higuchi释放模型方程的拟合,PLGA502H( r2 = 0. 9921)和PLGA502( r 2=0. 9754)的处方均表现出0级释放特征。而在PLGA752H处方下,整体释放速率较其他两种更快,释放拟合模型符合Higuchi方 程(r2 = 0. 9753)。因此,优先选择酯基封端的PLGA502继续进行考察。
3.5.2不同溶剂和释放调节剂对释放的影响
溶剂移除原位制剂系统中常用的有机溶剂主要分为与水混溶和与水部分混溶两种类型 。与水 互溶的溶剂容易形成均匀的凝胶贮库,利于注射,并且在皮下组织几分钟快速进行相转变。而疏水性溶 剂会在数周或数月进行相转变,被称为缓慢相转变,对应的制剂系统黏度较高,形成的贮库是均匀致密 有限的小孔,突释低 。本文作者选择向PL⁃ GA502/SAIB基质中加入不同溶剂和释放调节剂, 对比不同溶剂和混合溶剂的释放差异(图4)。
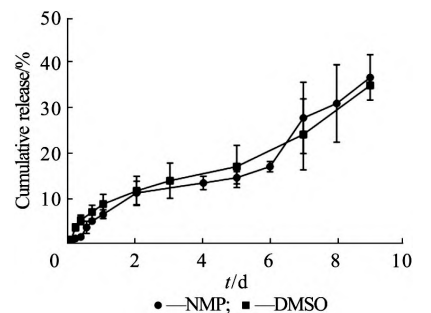
图 4 不同溶剂对体外释放的影响(x ± s,n = 3)
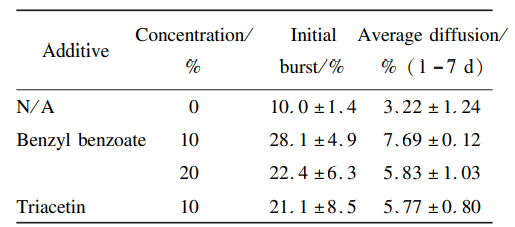
从图4可以看出,PLGA502/SAIB基质中加入NMP或DMSO,整体释放速率接近。采用DMSO作溶剂时,结果重复性较差,故优选 NMP为溶剂。向NMP中加入不同含量的疏水性溶剂(TA 和 BB)的释放曲线见图5,结果见表4,处方中分别加入质量分数为10%和20%BB后,24h突释率增长至(28. 1 ± 4. 9)% 和(22. 4 ± 6. 3)% ;加入10%TA 后,突释率增长至(21. 1 ± 8. 5)% 。24h突释率和平均释放率相比未添加疏水性溶剂具有显著性差异(P<0. 05)。这种现象也有类似的报道,可能的原因是依匹哌唑原料药在疏水 性 溶 剂BB( 4. 6 mg · mL-1,25 ℃ )和TA(2. 1mg·mL-1,25 ℃)中的溶解度较低,依匹哌唑原料药在处方中呈现悬浮状态,在注入介质后,未被基 质包裹的依匹哌唑原料药会快速随溶剂扩散出去,第9期邹倩等:依匹哌唑原位凝胶植入剂的体外释放研究 1137导致突释的增加。所以从降低体外突释的目标来说,处方选择不加入释放调节剂 BB和TA。

图 5 NMP/ 不同添加剂对释放的影响 (x ± s,n = 3)
表 4 不同添加剂对释放的影响
3.5.3 释放机制研究
由于体内环境和植入物形成微观结构变化机制的复杂性,体外往往很难去模拟制剂在体内的 释放过程。其中关键影响因素之一就是制剂在注 射部位形成植入物的尺寸和形状。Patel等使用扫描电子显微镜观察到PLGA/NMP基质在体外环境下,注射7d 后植入物呈现均匀的球形;在皮下注射后,移除时呈现平坦的圆盘状。这是由 于药物注射后受到皮下周围组织的压缩,成型后的植入物产生形变,产生更大的表面积。另外,与体内形成的植入物相比,在体外直接注射形成的植入物会经历更多的膨胀,但在体内周围组织的 间隙压力阻碍了植入物的扩张,迫使药物和溶剂机械性释放。所以原位凝胶制剂在体内通常会展 现出比体外更高的释放。为更好地表征处方的释放过程,降低体内风 险,阐明释放机制,本研究通过分层加样的方式(B)模拟制剂体内的挤压状态进行体外评价,加样装置(A和B)见图 6。在下方加入玻璃珠可以 使溶媒流动形成层流,在上方加入玻璃珠可以将 样品固定,同时形成挤压,模拟制剂在体内的挤压状态。已有类似改良加样方式的研究,Forrest 等采用分层加样的方式对纳米混悬液制剂进 行体外释放,可得到明显不同的三相释放结果。对PLGA502/NMP/SAIB 处方采用常用加样方式(A)与分层加样方式(B)分别进行研究。
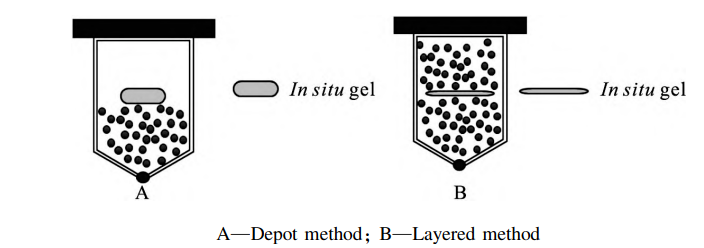
图 6 原位凝胶植入剂加入样品池的示意图
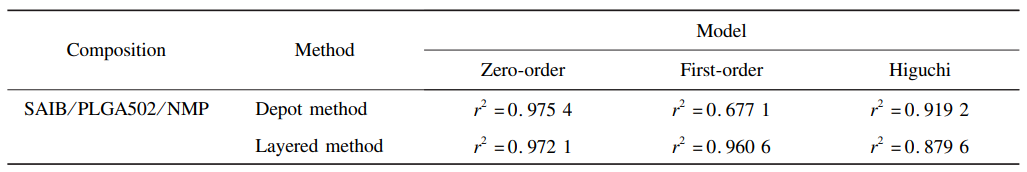
从图7可看出,采用分层加样方式(B)后,突释为(6.2 ± 1.8)%,相比直接加样方式的突释率(4.6 ± 0.9)% ,无显著差异。但从第5天开始,体外释放明显加快,14d可达(85. 4±2. 4)% ,达 到完全释放( > 80% )。随着介质的进入和溶剂 的扩散,聚合物载体逐渐膨胀,而玻璃珠的挤压使 得基质内的药物随溶剂扩散出来,导致药物释放 速率加快,释放过程以扩散为主。另外,对释放结果分别用0级、1级和Higuchi方程进行拟合,拟 合结果见表5。处方在不同释放方法条件下均表 现出0级释放的特征。这是由于PLGA502疏水性较强,可减慢介质进入基质的时间,使得降解主要发生在制剂表面,将药物的释放限制在可降解区域,以近似恒定速率进行释放。
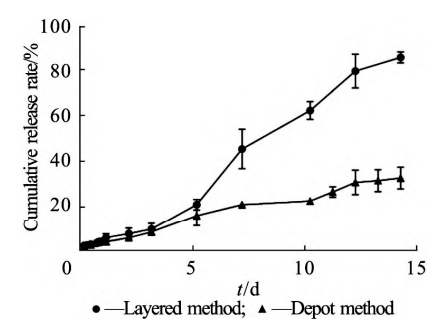
图 7 原位凝胶植入剂在不同加样方式的流通池法下的 体外释放曲线(x ± s,n = 3)
表 5 PLGA/SAIB/NMP基质处方体外释放模型拟合
四、讨 论
原位凝胶植入剂是一种新型长效注射剂,目前没有标准化的药典体外释放方法。本文参考上市产品、文献和药典方法,考察了多种原位凝胶注 射剂常用的体外释放方法。结果显示,流通池可以更好地反映依匹哌唑原位凝胶植入剂的体外释放行为并且具有良好的区分力。USP4法是目前认为最适用于缓释非胃肠道剂型的装置,闭环可模拟体内流体动力学变化且避免长时间释放过程溶媒的挥发,已有多个微球制剂采用流通池法并建立了良好的体内体外相关性 。
其次,本文作者以降低依匹哌唑原位凝胶植入剂的体外突释和释放速率为目标,对制剂处方的关键质量参数(PLGA 封端、L/G比例、溶剂、释放调节剂)进行了考察。在以NMP为溶剂时,酯基封端相较羧基封端的PLGA和PLGA752H结果相比,依匹哌唑原料药在PLGA502中的亲和力更强,表现出更好的缓释效果。在处方中加入疏水性溶剂苯甲酸苄酯和三醋酸甘油酯后,药物1d内的体外突释反而增加。由于原位凝胶植入剂在体内的释放过程十分复杂,释放可能会受到皮下环境、宿主与植入物之间的相互作用还有药物吸收的影响。本文作者则采用注射器吸取处方打入释放介质中成型,模拟处方经注射后在注射部位胶凝过程。优化加样方式,在成型后的植入物上方加入玻璃珠,模拟皮下挤压状态。改良加样方式后的流通池法可以使制剂在14d达到完全释放,有效缩短运行时间,不改变释放机制。本装置可作为评估原位凝胶植入剂在体内风险的方式,为进一步的体内研究奠定基础和提供数据支持。