时间:

摘 要
多环芳烃(PAH)是持久性环境污染物,偶尔会作为污染物出现在消费品中。当皮肤接触时,PAH会转移到角质层(s.c.)并穿过皮肤迁移,导致这类高毒性化合物具有生物利用性。在本研究中,通过体外Franz扩散池评估了24种PAH(包括广泛摩尔质量(M:152-302 g/mol)和辛醇-水分配系数(logP:3.9-7.3)范围)在人类和猪皮肤中的透皮速率。更亲脂性且可能毒性更强的PAH通过亲脂性较强的角质层向亲水性更强的活体(表观)真皮层的渗透速率降低。此外,人类皮肤的渗透性低于猪皮,猪皮是皮肤渗透研究中常用的替代物。特别是,人类皮肤的角质层保留了更多的PAH,对于较小的PAH,这种效果更为明显。此外,我们还比较了不同PAH在猪皮中的皮肤渗透动力学。虽然小分子多环芳烃(M < 230 克/摩尔,logP < 6)能迅速渗透皮肤,并在 2 小时后出现在受体液中,但大分子多环芳烃(M > 252 克/摩尔,logP ≥ 6)在长达 48 小时内都无法完全渗透皮肤。这表明,当转移到皮肤表面时,高亲脂性多环芳烃不像其较小的同类物质那样容易生物利用。我们的数据表明,猪皮可作为评估多环芳烃通过人类皮肤渗透的最坏情况场景的替代物。
01 引 言
多环芳烃(PAH)与众多健康风险有关(Kamal等人,2015年)。许多PAH被认为具有潜在的致癌性(IARC,2010年、2018年;Kamal等人,2015年;Kim等人,2013年;Rocha等人,2021年;WHO,2010年),包括皮肤接触后诱发皮肤癌的风险(Boffetta等人,1997年)。例如,苯并[a]芘(B[a] P)被归类为1级致癌物,而某些二苯并芘则被怀疑是更强的毒素(Collins等人,1998年)。除了癌症,PAH还与内分泌干扰有关(Zhang等人,2016年)、心脏病(Burstyn等人,2005年)和免疫抑制有关(van Grevenynghe等人,2005年),以及其他不良影响(Sousa等人,2022年;WHO,2010年)。因此,已经实施了多项法规来限制PAH的暴露(EC, 2006年;EC,2013年;EC,2023年;US-EPA,2021年)。然而,作为持久性有机污染物,PAH在环境中普遍存在(Haney等人,2020年;Hutzler等人, 2011年;Lao等人,2018年a、2018年b;Whitehead等人,2011年),偶尔也会作为污染物出现在消费品中,特别是那些含有炭黑或填充油的消费品(Alawi等人,2018年)。巴奇等人,2017 年;福尔加多·德·卢塞纳等人, 2018 年)。当多环芳烃与皮肤接触时,它们可以通过角质层(s.c.)扩散进入活性表皮,从而具有生物利用性。以及真皮层(巴茨,2018年;巴茨等人,2016年;西蒙等人,2023年b)。
皮肤渗透的研究可以通过体内或体外进行。体内研究存在将人类或动物暴露于有害物质和可避免风险的缺点。因此,涉及成熟的弗兰兹扩散池(FDC)检测的体外研究仍然是皮肤渗透研究的重要支柱(弗兰兹,1975;吴等人,2010)。FDC提供了一个简单的设置,其中目标物质通常嵌入或溶解在基质中,然后涂在皮肤或皮肤模型上。下面的受体室填充了水基流体,以模拟皮下层,并为完全渗透的物质提供储存库。在指定的时间段后,物质在皮肤内的分布及其在受体室中的浓度提供了有关皮肤渗透性的见解。
FDC(皮肤渗透)测试的金标准是人类皮肤。然而,人类皮肤并非总是容易获取,因为它必须来自整形手术患者的捐赠(巴茨等人,2016年;哈格瓦尔等人,2021年)或尸体(埃利森等人,2020年,2021年)。合成或实验室培养的皮肤模型是研究中越来越常用的替代品(莱莫恩等人,2021年;吴等人,2010年),但在监管背景下,它们尚未被推荐用于皮肤渗透研究(经合组织,2011年)。猪皮是人类皮肤最常见的替代品,因为它与人类皮肤具有关键特性。因此,猪皮在渗透相关参数(如滞后时间和扩散或分配系数)方面往往能提供相当的结果(格斯特尔等人,2016年;赫肯内等人, 2006年;罗特等人,2017年;SCCS,2010年)。此外,猪皮的获取相对容易(霍普夫等人,2020年)。然而,人类皮肤和猪皮之间仍然存在差异(邱英等人,2019年)。研究表明,猪皮对某些物质的渗透性比人类皮肤更高(巴贝罗和弗拉斯奇,2009年;罗特等人, 2017年)。目前尚未有关于PAH(多环芳烃)在人类皮肤和猪皮渗透的全面比较报告。
有人认为,高分子量(M)的多环芳烃(五个或更多环:大分子量的多环芳烃)通过皮肤的渗透率和通量低于低分子量的多环芳烃(两到三个环:小分子量的多环芳烃,Moody 等人,2011 年;Sartorelli 等人,1998 年、1999 年、2001 年)。然而,这些研究要么依赖于小样本量(n ≤2)),要么涉及非人类皮肤,要么仅报告受体液中的多环芳烃浓度,因此缺乏关于个体皮肤内分布特征的信息。
在此,我们汇集了来自一组 24 种不同环数(2.5 - 6 环,M =152 - 302 克/摩尔,支持信息(SI)A 中的表 A1 和图 A1)的经皮应用的 PAH 的几种 FDC 检测的数据。人类皮肤和猪皮在乙腈中的 PAH 溶液中孵育 24 小时。猪皮另外在不同的孵育时间(2 小时、4 小时、16 小时、48 小时)下进行孵育,以深入了解迁移动力学。随后,对处理后的皮肤样本的五层上部皮肤进行胶带剥落,分别从剩余皮肤和受体液中分析其 PAH 含量。通过气相色谱串联质谱法(GC-MS/MS)进行定量分析。最后,将 PAH 在皮肤层中的分布与其对数辛醇-水分配系数(logP)相关联。
02 方 法
此处呈现的数据是对与 FDC 检测同时进行的质量控制的汇编,旨在研究与皮肤有可预见的接触的消费品中皮肤多环芳烃(PAH)的渗透情况(Bartsch 等人,2016 年)。应用于皮肤样本的每种 PAH 在乙腈中的浓度设定为 1000 纳克/毫升。所使用的方法以及所应用的设备和化学品在前一项研究中已有发表。以下简要总结该方法以清晰明了。
2.1 皮肤
人类皮肤取自柏林夏里特医院的整形手术,源自女性腹部。进行渗透的提议对人类皮肤样本的研究经过了独立伦理委员会(柏林伦理委员会Charit´e,编号:EA2/090/14,2014 年 7 月 22 日)的审查和批准。侧猪皮来自 VION 食品有限公司(德国佩勒贝格),并冰镇交付。未烫伤的皮肤取自不会用于食品生产的死亡猪。两种皮肤类型均在− 20℃下储存,直至使用。
2.2 Franz扩散池测定法
Franz扩散池由一个用于将目标物质应用于基质中的供体腔和一个受体腔组成(推荐使用华溶TD-12AT PLUS透皮扩散系统)。受体腔填充有液体,并由水循环系统包裹,以保持皮肤处于恒定温度。皮肤或皮肤模型放置在受体腔上,并通过供体腔盖用夹具固定。到达受体液体的物质可被视为具有生物利用性。在本研究中,受体腔的温度保持在33℃,这相当于皮肤表面平均温度为32-35℃(Lee等,2019)。受体腔填充有等渗盐水(9克/升氯化钠),这被认为是皮下体液的良好近似值(Hoorn,2017)。
皮肤用皮肤切割机切成300微米厚,放置在受体腔室上。将捐赠帽固定在皮肤上,形成1.76平方厘米的暴露区域。根据经济合作与发展组织(OECD,2004)的指南428,测量跨表皮水分流失(TEWL)以确保皮肤的完整性。如果皮肤样本的TEWL大于先前通过验证实验确认的特定皮肤类型的平均TEWL的30%,则将该皮肤样本从研究中排除(Bartsch等,2016)。将含有24种多环芳烃(PAH)的溶液(1000纳克/毫升,具体列表见SI A的表A1)50微升涂在皮肤上(相当于28纳克/平方厘米的真皮剂量),并在指定的时间间隔(2-48小时,表1)内进行孵育。对于阴性对照,应用50微升纯乙腈。
在指定的孵育时间后,所有样本都添加了内标(选定的氘化多环芳烃,将分析物与内标关联:SI A的表A1)。用生理盐水(9 g/l氯化钠)冲洗供体室,然后将皮肤从组件上剥离,用五条胶带条剥离,然后将它们合并。一条胶带条被证明可以去除一层皮肤(Simon等,2023a),因此,将五个上层皮肤层一起分析。使用乙腈提取胶带条,然后用正己烷再提取。这种双重提取有助于最小化由从胶带上提取粘附物引起的基质效应。剩余的皮肤使用乙酸乙酯提取,受体液经过固相萃取(反相C18),然后用二氯甲烷洗脱多环芳烃。所有获得的提取物然后在氮气流下浓缩,重新溶解在乙腈中,并通过气相色谱-质谱/质谱法分析其多环芳烃含量。关于测量程序的更多细节在先前的出版物中提供(Bartsch等,2016)。这得出了三个部位的 PAH 浓度:(i)上皮皮肤(源自五条胶带),(ii)剩余皮肤,(iii)受体液。
表 1 每种皮肤类型和每种孵育时间下进行的弗兰兹扩散细胞试验的重复次数(n)

2.3 数据分析
数据使用统计编程语言R(版本4.2.2)进行分析。数据进行了夏皮罗-威尔克正态性检验。如果数据不符合正态分布,则使用格鲁布异常值检验进行异常值检测。如果检测结果为阳性,则异常值将被删除。从净化数据集中计算出每种PAH、皮肤类型、分区和孵育时间的平均值和标准偏差。所有统计检验的结果总结在SI B(表1和表2)中。基于每种PAH穿透皮肤的量(包括所有分区,包括受体液体的总和),计算出PAH在每个分区的分布比例。
方程(1)被用于拟合数据,并突出两个变量 y 和 x 之间的关系,其中 u 和 w 是回归参数:
![]()
03 结果与讨论
在皮肤渗透研究中,我们将一系列广泛的多环芳烃从乙腈迁移到人类皮肤及其最常见的皮肤替代物之一(猪皮)中的迁移情况进行了比较(SCCS,2010;西蒙和迈巴赫,2000)。此外,我们将多环芳烃在猪皮上孵育不同时间,以产生每种研究多环芳烃的动力学特征。在本研究中,最小且最不亲脂的多环芳烃是芘并芘(M = 152 g/mol,logP = 4.0,卢等人,2008)和芘并芘(M = 154 g/mol,logP = 3.9,卢等人,2008),最大且最亲脂的多环芳烃是二苯并芘(M = 302 g/mol,logP = 7.2-7.3, PubChem,2023b,c,d,e;美国环保署,2012)。所有24种研究多环芳烃的全面列表见表A1和图A1(SI A)。对于研究的多环芳烃,logP和M呈线性关系(图A2和方程(A.1),SI A)。包含每种多环芳烃在每个孵育时间对两个物种和所有分室的量化质量、数量和比例的数据总结在SI B的Sheet 3中。
在欧盟(欧洲共同体,2023 年),对于长期或反复短期皮肤接触的消费产品,多环芳烃(PAH)含量的监管限值为 1 毫克/千克(玩具为 0. 5 毫克/千克)。然而,过去在某些消费产品中测量到的数值要高得多,高达约 50 - 270 毫克/千克(Bartsch 等人,2017 年;BVL,2017 年)。当这些产品与皮肤接触时,预计会出现本研究中添加的 PAH 剂量(28 纳克/平方厘米)范围内的皮肤暴露(例如,皮肤接触 24 小时后,含有 166 毫克/千克 B[a]P 的锤子手柄释放了 102 纳克/平方厘米的这种 PAH, Bartsch 等人,2016 年)。在不同的暴露场景中,某些特定人群,如消防员,可能会经皮肤接触到更高含量的空气borne PAH(4 至 1200 纳克/平方厘米,Sousa 等人,2022 年)。
先前的研究表明,高浓度的多种多环芳烃以及相当复杂的基质作为应用介质(Bourgart 等人,2019 年;Hopf 等人,2018 年)既能降低多环芳烃的皮肤渗透率。然而,在本研究中,应用剂量分别比上述研究低 50 倍(Bourgart 等人,2019 年)和 5000 倍(Hopf 等人,2018 年),并且多环芳烃是以溶剂基溶液的形式应用,而非复杂的混合物。在此,我们研究了其在不同皮肤部位的相对分布。因此,在接下来的章节中,我们的讨论基于相对量,这些相对量是针对每种渗透入皮肤的多环芳烃的总量进行标准化的。这也使得在不同部位对单个多环芳烃进行比较更加容易。此外,它还弥补了在皮肤和受体部位检测到的多环芳烃的回收率与应用于皮肤的总量相比偶尔出现的相对较大偏差(补充信息 B 的表 3)。
3.1 经皮涂抹的多环芳烃在人类和猪皮肤中的分布
多环芳烃的亲脂性越强,就越容易被皮肤吸收(见图1,24小时孵育时间;其他孵育时间在猪皮中的情况见图A.3,SI A)。在之前的研究中,当比较苯并芘和二苯并芘的皮肤迁移时,观察到了类似的效果(Bartsch等,2016)。由于所研究的多环芳烃的logP和M呈线性相关,这些结果也可以同样地解释为摩尔质量。然而,由于在本研究中,超过所研究的最重多环芳烃M的亲水性物质被证明能够有效地渗透皮肤(Ellison等,2020,2021;Potts和Guy,1992),亲脂性可能是更重要的因素。
我们最近证明,表征多环芳烃在角鲨烷和皮肤中分布的分配系数取决于各自多环芳烃的M和logP值(Simon 等人,2023b)。高脂溶性多环芳烃更容易从这个脂溶性基质中分配到皮肤中(logP=15.6,ACD/Labs,2021)。因此,对于乙腈(logP=−0.3,PubChem,2023a),由于更脂溶性化合物应该更容易从这个极性溶剂中分配到疏水性皮肤中,预计会有类似但更显著的趋势。同样,对于水性基质和皮肤,一系列广泛的脂溶性(logP>3)物质的分配系数与 logP呈正相关(SI A中的图A.4)。关于多环芳烃渗透到更深皮肤层,应用介质的影响应该不太相关。然而,在孵育期间,乙腈可能已经穿透到皮肤中,有选择性地增强了较小、不太脂溶性多环芳烃的渗透。
由于土壤是一个相对亲脂的基质(雷卡尔等人,1988 年),亲脂性更强的多环芳烃应该也能被土壤更有效地保留。
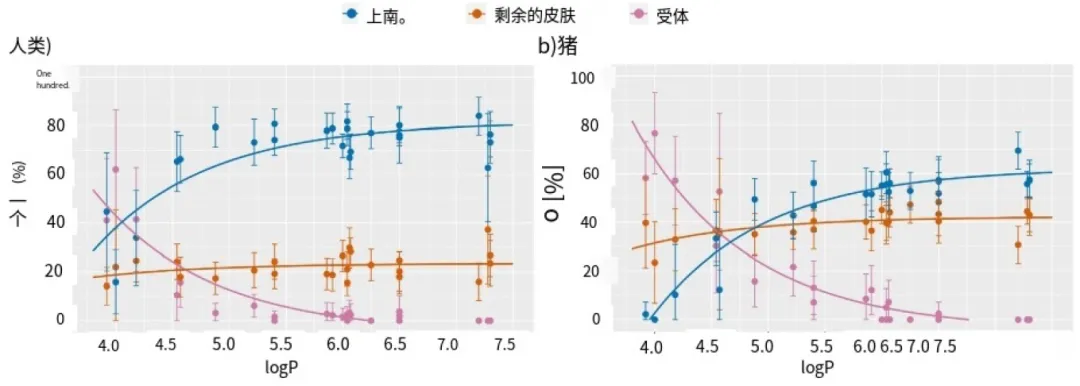
图 1.多环芳烃在各室(角质层(s.c.)、剩余皮肤)中的分布比例与 24 小时孵育时间后皮肤(角质层(s.c.)、剩余皮肤)和受体液中发现的总量,与辛醇 - 水分配系数(logP)的对数相比。均值±偏差。曲线表示拟合到方程(1)的数据。a) 人类皮肤(n = 13)。b) 猪皮(n = 9)。对于猪皮的其他孵育时间(n = 3),请参阅补充信息 A 中的图 A3。
在s.c./活表皮边界层处。实验证实了这一点:孵育24小时后,低logP的多环芳烃渗透到整个活真皮,主要在FDC的受体液中检测到。猪皮的这种效果比人的皮肤更强。相反,大的多环芳烃在研究的时间框架内没有完全渗透皮肤,也没有在受体液体中发现。包括溶解度增强剂(如白蛋白)的替代受体溶液可能更好地溶解这些高亲脂性多环芳烃。尽管如此,当受体溶液中含有50 mg/ml BSA时,即使在6μ g/cm2范围内非常高的皮肤剂量下,也只观察到少量渗透(Simon等人,2023b)。由于活的表皮和真皮层的相当含水的层位于s.c以下,亲脂物质仍然需要克服这一屏障。
通过将方程(1)拟合到数据上(图1;参数:SI B,表4),可以近似计算出每种多环芳烃在上皮、剩余皮肤和受体液中的分布比例。当绘制这些曲线时,它们有助于直观地展示出各个分布比例对logP的依赖关系。此外,它们还表明,多环芳烃在每个分布比例中在logP约为6.0时趋于一个极限。对于较大的多环芳烃,无论生物物种(猪或人类)如何,分布比例不再进一步变化。一个可能的解释是,更亲脂性的多环芳烃更倾向于分配到亲脂性更强的上皮中,而不是亲水性更强的表皮下。另一个假设是,它们与皮肤蛋白的相互作用存在差异。如果较大的多环芳烃对这些蛋白质的亲和力更高,它们也会被更牢固地保留。原则上,其他物理化学性质也可能调节渗透过程。例如,研究表明,分子体积与多环芳烃通过皮肤的通量有关,尽管在我们的数据中未发现统计学上显著的差异(Alalaiwe等, 2020)。
在剩余皮肤中检测到的部分,对于人类或猪皮的 logP 值而言,都没有实质性的变化。所应用的胶带剥落程序仅涉及五条胶带,从剩余皮肤中仅去除五个上层皮肤角质层(Simon 等人,2023a),因此该部分包含大部分皮肤角质层以及皮肤角质层/活表皮边界层。因此,在这个部分中发现了穿透活表皮的中小型多环芳烃以及主要保留在皮肤角质层中的大型多环芳烃。
3.2 人类皮肤和猪皮对多环芳烃渗透率的比较
人类皮肤比猪皮更能有效地保留小PAH。这反映在24小时孵育后,猪皮中受体液中小PAH的比例高于人类皮肤(图1)。同样,残留皮肤中这些物质的含量也较低,平均而言,人类皮肤的含量更低。这些结果与之前对亲脂性化合物的研究一致。例如,一项关于庚烷、十六烷和二甲苯(logP>3)的研究发现,这三种物质在猪皮中的渗透系数高于人类皮肤(Singh等,2002年)。
回归曲线(方程(1)),将人类与猪皮肤中检测到的多环芳烃相对含量的比率作为对数P的函数进行拟合,当对数P较大时,渐近地达到一个极限值0.60(图2;数值:SI B的Sheet 5,拟合参数:Sheet 6)。因此,对于更亲脂的多环芳烃,猪皮肤更能模拟人类皮肤。以前的研究表明,人类皮肤中的脂质与猪皮肤中的脂质相比,排列方式不同(正交侧向排列),密度更大(六方侧向排列),尽管不同脂质的摩尔比大致相等(Caussin等,2008)。这些更紧密排列的脂质可能会减缓人类皮肤中较小多环芳烃的扩散。另一方面,较大多环芳烃在两种物种的皮肤中保留方式更相似,差异不太明显。
我们之前测定了多环芳烃在猪皮肤中的扩散系数,对于对数P>4的多环芳烃,扩散系数相似,而萘(对数P=3.4)的扩散系数显著更高(Simon等,2023b)。这可能暗示对数P>4时扩散机制的变化人类和猪的皮下组织中扩散速率的价值以及它们之间的更紧密关系。
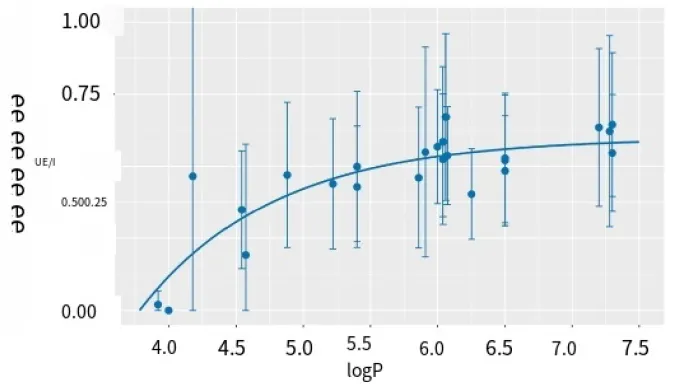
图 2.在 24 小时的孵育时间下,人类角质层中发现的多环芳烃(PAH)的相对量与猪角质层中发现量的比值,与 PAH 的辛醇 - 水分配系数(logP)的对数。均值±偏差。曲线表示拟合到方程(1)的数据。芴标准偏差的上限:1.45 。
然而,获取皮肤样本的解剖部位似乎对皮肤的渗透性组成没有显著影响,正如之前的研究表明的那样(Khiao In 等人,2019 年)。此外,据报道,冷冻不会显著改变人类皮肤的渗透特性(Jacques-Jamin 等人,2017 年)。相反,猪皮则受到了影响:在−20℃冷冻和储存后,对亲脂性模型物质水杨酸甲酯的渗透率比新鲜猪皮增加了多达 25%(Morin 等人,2023 年)。通过直接比较大鼠、兔子和猪皮,这一影响得到了支持,表明后者尤其容易受到冷冻的影响(Sintov 和 Greenberg,2014 年)。由于我们使用的是冷冻的皮肤样本,这种影响可能导致观察到的多环芳烃通过猪皮的渗透率高于人类皮肤。
3.3 多环芳烃的皮肤渗透动力学
一般来说,亲脂性较差的PAH比亲脂性较强的PAH渗透皮肤的速度更快。这一点从相对较短的时间内(仅2小时)在受体室检测到的小型PAH的量相对较高可以看出,而大型PAH则在上皮中保留到48小时,并且根本不会渗透到受体液中。例如,在2小时后,从皮肤和受体室回收的芘蒽(一种小型、2.5环的PAH,图3a)的量中,几乎60%检测到在受体液中,而不到20%留在上皮中。相反,在相同的孵育时间下,二苯并[a,1]芘(一种大型、6环的PAH,图3c)在上皮中的回收率超过75%,并在4小时后稳定在约70%,而即使在48小时后,在受体液中仍未检测到。由于在超过40小时的时间段内未检测到分布模式的显著变化,我们怀疑即使延长孵育时间,大型PAH也不会完全渗透皮肤。值得注意的是,这种长时间的暴露不太可能反映涉及通过皮肤接触向消费者产品转移PAH的真实暴露场景。然而,在研究的时间框架内,在皮下积累但不进一步深入的持久性芳香烃可能会形成一个储库,在后期时间点似乎有可能从该储库迁移到皮肤中。皮下细胞层的更新约为 14 天,这使得积累的化合物最多有两周的时间分配到活皮肤中(米尔斯通,2004 年)。
对中等多环芳烃(如芘)的动力学分析(图 3b)表明,2 小时后,穿透皮肤进入的芘的量中仅有约 4%到达受体液,近 70%被上层皮肤保留,28%留在剩余的皮肤中。然而,14%的受体液,其余部分在上部皮肤和剩余皮肤之间大致均匀分布。48 小时后,几乎四分之一的多环芳烃的量迁移到受体液中。所有其他研究的多环芳烃的皮肤渗透动力学结果见图 A.5 - A.7(SI A),并显示出类似的趋势。
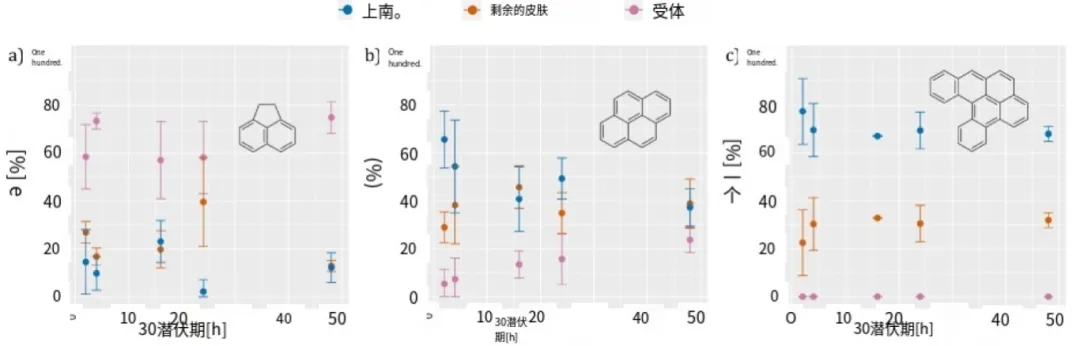
图 3 在不同孵育时间下,所选多环芳烃(PAH)在不同隔室中的分布比例与在猪皮和受体液中发现的总量的关系。均值±偏差。24 小时:n = 9;其他孵育时间:n = 3。a) 芘蒽(154 克/摩尔,logP = 3.92),b) 芘(202 克/摩尔,logP = 4.88)和 c) 二苯并[a,l]芘(302 克/摩尔,logP = 7.20)。对于所有其他 PAH,请参阅补充信息 A 中的图 A5 至 A7。
04 结 论
通过涉及人类和猪皮的体外 FDC 测定,我们表明,广泛的多环芳烃的皮肤渗透效率在很大程度上取决于 logP,因此也与 M 相关。在类似于皮肤接触可能受多环芳烃污染的消费产品的时间框架的孵育时间内,发现小分子量和在较小程度上中等大小的多环芳烃相对较快地到达受体液(例如,在 2 - 4 小时内)。另一方面,对于高度亲脂性的多环芳烃,上皮层是皮肤渗透多环芳烃最重要的屏障。这些较大的多环芳烃不会从亲脂性较强的上皮层显著分配到更具水性的活性表皮中,并且在上皮层中有效保留长达 48 小时。这在上皮层和剩余皮肤中多环芳烃的回收得到了支持,后者包含上皮层的大部分。由于在 FDC 测定中,大分子量的多环芳烃未到达受体液,因此它们大概不会转移到体内循环中,而是随着时间的推移,通过受污染层的脱屑最终被去除。另一方面,不能排除在皮肤中形成储库,并在较长时间内随后迁移到表皮的可能性。此外,我们表明猪皮对多环芳烃的渗透性比人类皮肤更强,而对于小分子和亲脂性较弱的多环芳烃,这种差异更为显著。