时间:

翻译:华溶应用中心
审核:工业药剂发烧友
简介:
从历史上看,为了证明生产工艺或辅料的变更对产品的质量、疗效和一致性的影响,需对半固体药物产品进行生物利用度/生物等效性研究,这类研究工作一直具有挑战性。体外测试如溶解度、粒径、活性成分释放率和产品均匀性的测定,已成为考察产品均匀性和质量等效性的主要指标。其中,活性成分的体外释放试验(IVRT)因《非无菌半固体剂型工艺指南》(SUPAC-SS)的颁布而备受关注。
许多外用药物制造商在药物开发过程中投入了大量资源来开发和验证IVRT。然而,正如工厂检验计划意见书所指出的那样,没有一个标准的测试方案可以适用于所有半固体剂型。本研究采用Franz扩散池对不同半固体制剂中的维甲酸进行了释放试验,测试的产品是含有维甲酸的乳膏。使用维甲酸开发并验证IVRT,然后将IVRT方法应用于制剂开发,并证明工艺变更的影响。选择维甲酸是因为它有较多规格类型可以提供研究,且前人对维甲酸乳膏中维甲酸的释放研究比较充分。
1、试验方法:
虽然通常有一种测定方法可用于测定目标原料药及其相关化合物,但这种方法可能不适合原料药在特定的接收介质下进行检测。在大多数情况下,在选定的接收介质中分析这些化合物时,为了保证IVRT结果的可靠,需要对方法进行一定程度的修改,并对修改后的方法进行完整的验证。对测定方法进行了修改,以测定含有30-35%乙醇的磷酸盐缓冲液(pH 5.5)中的微量维甲酸,经过实验30-35%乙醇被证明是维甲酸释放的适当有机相范围。
2、膜的选择:
所选择的膜应为试验试剂提供持续的惰性接触表面,允许活性成分从剂型中释放时容易扩散到接收介质中,而不能成为限速屏障。重要的是要确认膜和制剂之间没有物理或化学的相互作用。在许多情况下,制剂中存在的辅料可能影响膜的物理完整性,制剂的活性成分还可能与膜结合发生粘附,难以扩散。此外,膜不应含有任何可能干扰活性成分测定的可浸出物。在方法开发之初,常用的膜有Tuffryn、聚醚砜树脂、纤维素、醋酸纤维素、尼龙、特氟龙和聚碳酸酯。建议在IVRT实验预期的上限和下限浓度范围内,选几个浓度水平制备受试化合物在接收介质中的标准溶液,用于验证药物与膜的结合程度。用市售的过滤器将测试的膜装好,将维甲酸标准溶液通过这些膜进行过滤,并分析过滤后标准溶液中视黄酸的回收率。
对含维甲酸的制剂,参照文献选取浓度为0.1、0.02 μg/ml的药物进行膜吸附检测。在筛选的膜中,聚砜树脂膜和Tuffryn膜在低水平(0.02 μg/ml)下对维甲酸有明显吸附。高效液相色谱(HPLC)显示,醋酸纤维素膜回收率最高,无正干扰(表1)。因此,选择醋酸纤维素膜进行进一步的方法开发和验证。
许多研究者建议用接收介质或0.5%肉豆蔻酸异丙酯浸泡膜进行预处理。然而,对于维甲酸乳膏,膜的预处理对总体释放曲线几乎没有影响。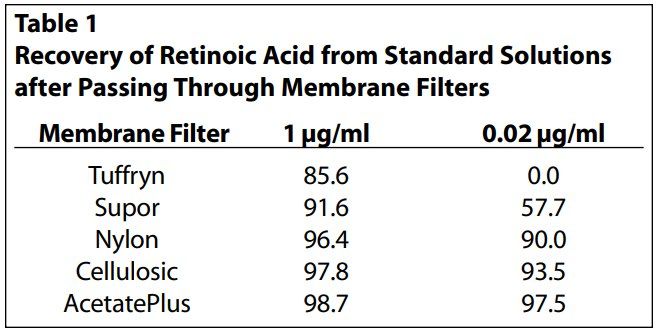
3、接收介质选择:
虽然希望接收介质与皮肤的生理状况相似,但也必须确保药物有足够的释放可以无偏差地被测量,选择接收介质时最重要的因素是活性成分在介质中的溶解度,接收介质需要为活性成分从半固体制剂中释放提供外部的扩散条件。Q(累积释放量)与√T(时间的平方根)的关系是从Higuchi模型推导出来的,该模型假设始终有药物储库可用。根据经验,在实验结束时,释放到介质中的剂量不应超过所使用剂量总量的30%。
介质的pH值也是一个需要考虑的重要因素。介质的水性组分pH值应基于制剂的pH值、活性成分的pH-溶解度曲线和目标膜的pH值来选择。对于接收介质,一个实际的考虑因素是选择的接收介质应满足在合适时间内释放足量活性成分,以确保准确分析样品释放速率。
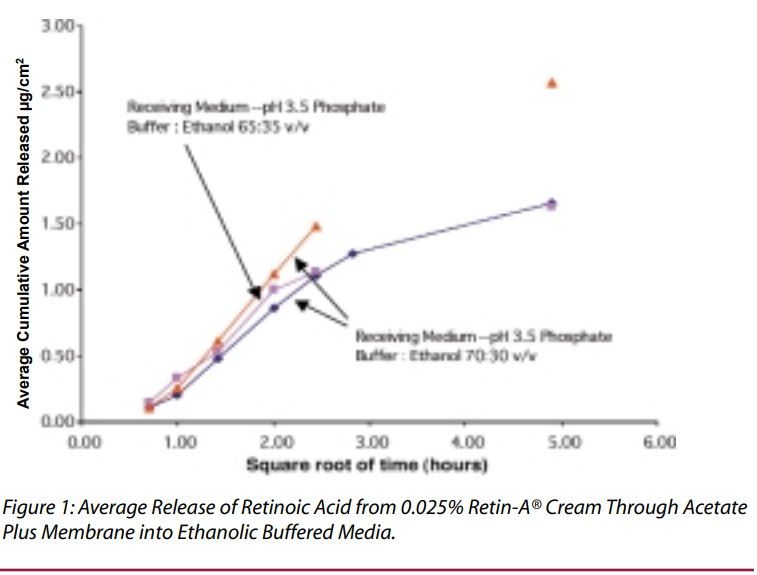
维甲酸在乙醇接收介质中的溶解度足以满足上述所有要求。经过几次初步实验后,选择含有35%乙醇的pH3.5磷酸盐缓冲液作为接收介质,该介质允许足够水平的维甲酸从制剂中释放并通过膜扩散,以准确分析维甲酸释放情况。使用pH3.5和pH5.5缓冲液(分别为受试制剂的pH和皮肤pH)对几种试验用制剂进行平行检测,0.025%维甲酸乳膏的释放速率在pH 3.5缓冲液中较快,而某些原研制剂(8和9)在这两种pH缓冲接收介质中的释放速率几乎没有差异(表2)。我们将pH5.5的缓冲液:乙醇(65:35 v/v)作为进一步实验的接收介质。乙醇浓度的小幅度变化不会导致维甲酸释放率发生显著变化。(图1)。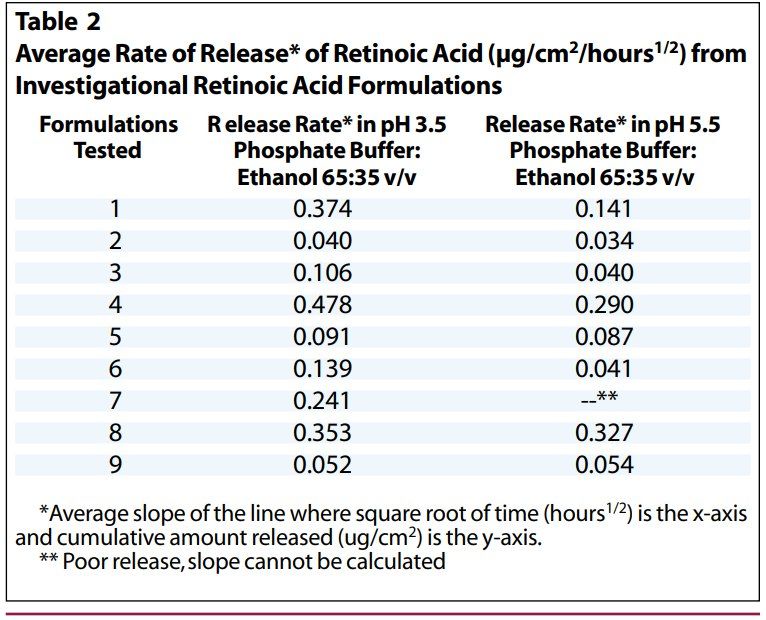
4、设备相关参数的选择和药物释放度计算:
在进行释放试验时应考虑以下具体的设备相关参数。仪器通常使用6个Franz扩散池用于释放试验(推荐使用华溶TD-12AT透皮扩散系统)。推荐使用华溶TD-12AT透皮扩散系统试验温度在大多数情况下,当剂型应用于皮肤时,32℃是合适的。特殊情况是,当剂型应用于管腔膜,如阴道粘膜,在这种情况下,37℃更合适。我们本次研究所有的实验都使用32℃。
取样时间点(h):0.5、1、2、4、6、8、24、48。
取样体积:每个时间点取样0.2ml,每次用新鲜介质补液。
计算:维甲酸在膜单位表面积上的累积释放量(Q)为:
n-1 Q= {CnV+∑CiS}/A i=1
其中
Q =膜单位面积维甲酸累积释放量(µg/cm)
Cn =第n个采样间隔测定的维甲酸浓度(µg/ml)
V =单个Franz扩散池的体积
n-1 ∑Ci =在采样间隔1到 n-1期间测定的维甲酸浓度之和(μg/ml)
i=1
S =取样等分液的体积,0.2 m
A =样品孔的表面积。本次实验表面积为1.767 cm2
通常,需要对具有已知差异的制剂进行验证。在这种情况下,该方法首先使用已上市产品retin-A乳膏进行验证,确认方法的可行性,然后将验证后的方法应用于具有已知差异的自制制剂,以确认该方法对正在进行工艺探索的不同制剂的区分能力。
验证的内容
(1)、重现性:评价仪器的长期稳定性、方法的稳定性、 操作对结果的影响等
(2)、准确度:不同时间测试的同一制剂批次之间的一致性
(3)、剂量规格对释放速率的影响
(4)、组成变化对释放速率的影响
(5) 、工艺参数变化对释放速率的影响
(6)、剂型粘度变化对释放速率的影响
1、重现性: 评价仪器的长期稳定性、方法的稳定性、 操作对结果的影响等
在没有Franz扩散池重现性考察标准品的情况下,使用内部标准品Retin-A乳膏0.025%作为参比制剂。此外,还计算了样品释放时间平方根(x轴)和单位面积累计释放量(y轴)所描述的直线的斜率和相关系数。相关系数< 0.98的直线不符合要求
2、 准确度: 同一成分在不同时间测试的批次之间的“一致性”
若用具有相同成分和相同制备工艺的维甲酸乳膏在不同时期试验,这些制剂应有非常相似的释放速率。表3显示了一个示例。
3、计量对释放速率的影响
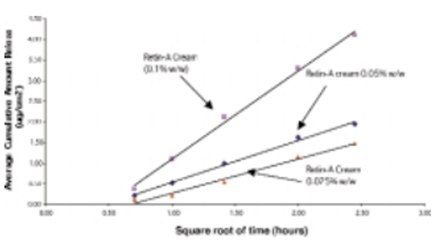
在上述条件下,测定了剂量规格为0.025%、0.05%和0.1%的维甲酸乳膏中维甲酸释放情况 (上样量都一致,但规格不同),评价规格对释放速率的影响。图2显示了这些处方中维甲酸的释放曲线。在pH 5.5磷酸盐缓冲液:乙醇(65:35 v/v)溶液中维甲酸乳膏的药物释放速率和释放总量成正比。图3显示了三批相同的自制维甲酸制剂的释放曲线,两批为0.025%,一批为0.05%。虽然初始释放速度较慢,但与在维甲酸乳膏中观察到的释放量和释放速度比值相同。因此,在试验的第一个小时后,释放药物的平均累积量与时间平方根之间存在线性相关性。
4、组成变化对释放速率的影响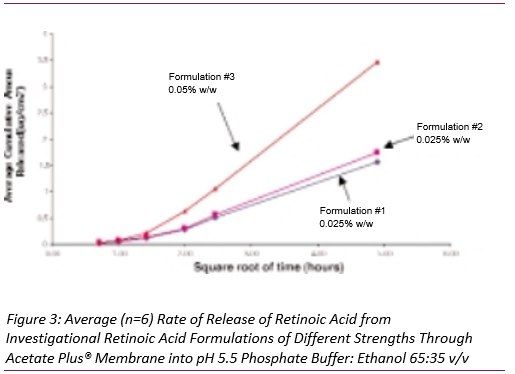
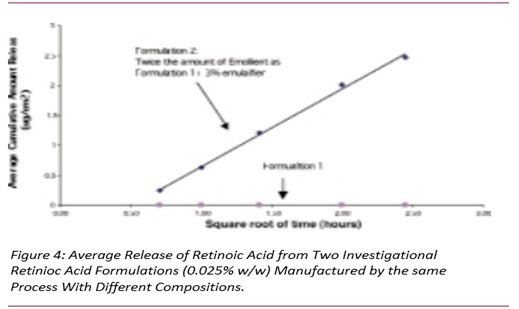
图4显示了两种0.025%规格制剂中维甲酸的释放。采用相同工艺生产,制剂1几乎未释放出视黄酸,而制剂2释放出大量维甲酸,制剂2含有两倍量的润滑剂和其他调节剂。
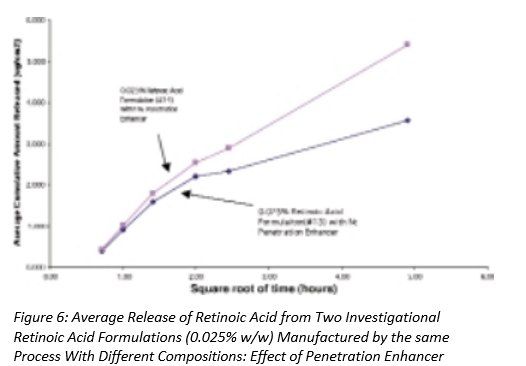
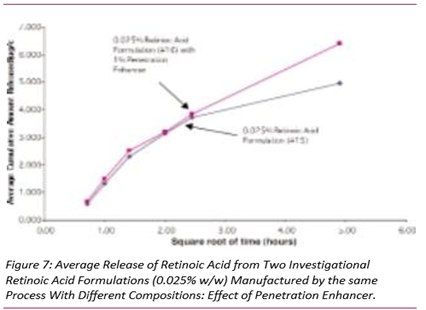
图5-7显示了三组自制制剂中维甲酸的释放,其中制剂之间的唯一差异是是否存在渗透促进剂。在图5和图6中,添加了该成分的维甲酸释放量更高,而在图7中,两种制剂的释放量没有显著差异。请注意,这些制剂的粘度存在差异,这可能会对药物释放产生影响。(见下面的讨论)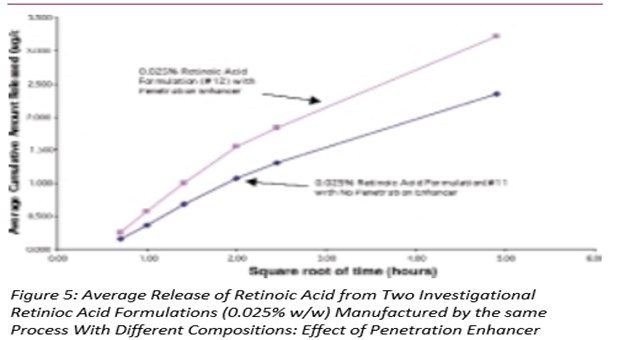
5、工艺参数变化对释放速率的影响
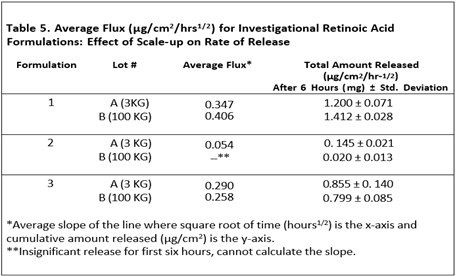
表4显示了维甲酸完全直接溶解在油相或者预溶于有机溶剂中的两种制剂。当药物全部或部分预溶于有机溶剂时,维甲酸的释放量更大。从实验室规模扩大到生产规模是一个必须评估的变量。对于剂型研究,批量从3KG扩大至100 KG对自制制剂3的释放率没有影响,但对自制制剂2的释放有显著影响。表5显示了不同规模生产的自制制剂的药物释放比较结果。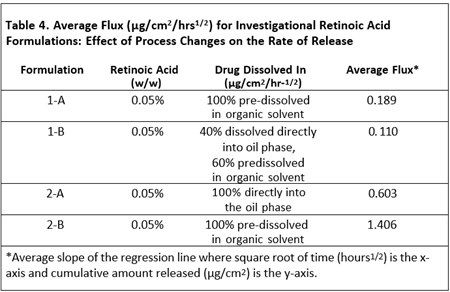
6、粘度变化对释放速率的影响
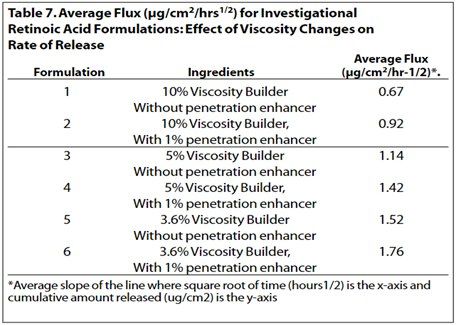
粘度是半固体剂量的关键属性之一,观察到粘度变化对维甲酸从原研制剂中释放的有显著影响。表6和表7显示了黏度增强剂对这些处方中药物释放的影响。在表6中自制制剂1-4、5-7和8-11均显示出相似的趋势,即维甲酸的释放量与制剂中粘度度增强剂的量成反比。
在表7中,自制制剂1-6显示了组分变化和粘度变化对维甲酸释放的综合影响。其对制剂组1-2和3-4之间的释放曲线影响显著,对制剂5和6之间的影响不太明显 (见图5-7)。然而,制剂1和2、3和4以及5和6均显示出类似的趋势,即药物释放与制剂中的粘度增强剂的量成反比。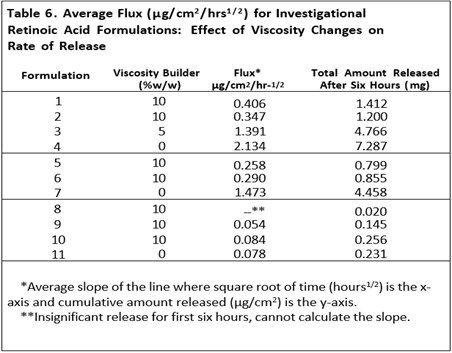
(1)、维甲酸的IVRT可以区分制剂的处方组成、生产工艺和粘度的变化。
(2)、本研究为维甲酸制剂开发中IVRT提供了一种评估药品质量和SUPAC-SS要求的“一致性”的有用工具。
(3)、应注意,IVRT仅对那些被测试的参数有
(4)、必须具体确定乙醇(在接收质中)反扩散对制剂的影响,以及每种方法变量“灵敏度”(最小鉴别浓度差异),作为完整方法验证的一部分。
略
如需原文,请联系小编(15012941165)