时间:
 翻译:华溶应用中心
翻译:华溶应用中心
审核:工业药剂发烧友
体外药物释放测试和体外经角膜药物渗透可以在动物研究之前提供Q1/Q2等效软膏性能的有价值信息。体外和离体药物释放的良好相关性可能表明体外和体内的良好相关性。因此,研究Q1/Q2等效眼膏的体外和离体药物释放,并评估是否可以建立这些释放曲线之间的相关性具有重要意义。我们使用来源不同的赋形剂和加工方法,制备了4种Q1/Q2当量氯替泼诺眼膏。测定4种制剂的流变学参数(交叉模量和K值)。使用3种不同的仪器(Franz扩散池、USP 2浸没池装置和USP 4半固体适配器)进行4种软膏制剂的体外药物释放试验。采用三种模型(零阶模型、对数模型和Higuchi模型)研究软膏制剂的体外释放动力学。采用Franz扩散池对兔角膜进行透角膜研究。USP 4法较USP2法和Franz扩散池法具有更好的鉴别能力。使用Higuchi模型(R2> 0.98)对4种不同制造方法的Q1/Q2等效软膏的体外释放曲线进行了分析,结果3种测试方法的拟合度均优于其他2种模型。药物通过兔角膜的体外释放表现为零级释放动力学。流变学参数(交叉值和K值)与经角膜通量呈对数相关。此外,4种软膏制剂的体外释放率与体外释放通量的曲线显示,3种释放方法的释放率均呈直线(R> 0.98)。因此,流变学参数可用于预测软膏的体外和离体释放特性。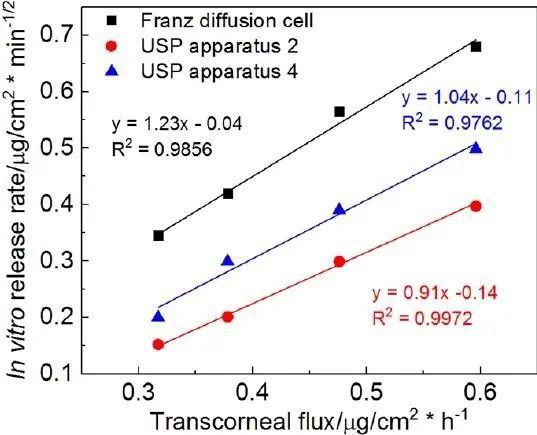
由于药物在角膜表面的滞留时间短、在角膜前迅速消失,药物的生物利用度低,限制了眼局部给药。在滴眼液后,高达95%的药物会由于流泪和非生产性吸收而丢失。人们已经做出了巨大的努力来提高眼部药物的生物利用度,使用不同的机制,如原位凝胶,接触镜,黏度增强剂和黏液黏合剂。然而,迄今为止,传统剂型(如滴眼液、悬液和眼膏)仍然是治疗眼部疾病的主流剂型,约占FDA批准的市售眼局部药物的97%。在已上市的眼用剂型中,眼膏(主要是油型)约占10%,仅次于眼用滴眼液。与其他常规眼局部剂型相比,传统的油状眼膏在眼表停留时间较长,给药频率较低,患者依从性较好,是首选的眼膏。然而,目前对眼膏的剂型设计和加工,以及眼膏的体外、离体和体内性能缺乏了解,涉及这些方面的最新文献较少。
根据FDA指南,关键质量属性(CQA)是一种物理、化学、生物或微生物性质或特征,应在适当的限度、范围或分布内,以确保所需的产品质量。cqa通常与原料药、辅料、中间体(中成品)和药品相关。剂型的cqa通常是影响原料药纯度、稳定性和药物释放的方面。了解药品的关键质量属性及其对产品性能的影响对于促进生产和监管审查以实现可重复和安全的药品至关重要。在定性(相同成分)和定量(相同浓度的相同成分)(Q1/Q2)等效配方的制造中,据报道,微小的制造变化(例如,制造地点变化,在加工中使用的不同溶剂,赋形剂等级和来源等)可能会导致在体外和体内表现有显著差异。因此,开发能够区分具有生产差异的制剂的体外溶出方法非常重要。
为了进一步了解关键属性如何影响具有生产差异的Q1/Q2等效眼用制剂的体内性能,最好的方法是进行体内研究。然而,这些研究耗时、昂贵且需要大量的动物。另一方面,体外或离体模型在研究眼内渗透和吸收方面更经济和更符合伦理。这样的模型在初步配方开发过程中可能特别有用。最近对常用的的体外和离体模型进行了综述。由于兔眼的解剖结构与人眼最相似,因此兔眼模型是体内和离体角膜研究的首选模型。被动扩散的药物,体外渗透和体内吸收之间具有良好的线性相关性(r2 = 0.95)。药物释放的良好的体外相关性可能表明良好的体内外相关性。
本研究对氯替泼诺眼膏进行研究。氯替泼诺是第一代皮质酸软性类固醇之一,广泛用于眼部炎症性疾病的治疗。在生理条件下,氯替泼诺产生治疗作用后转化为非活性代谢产物。与其他糖皮质激素相比,氯替泼诺的软药设计使其毒性更小,治疗指数更高。迄今为止,美国食品药品监督管理局(FDA)批准的氯替泼诺眼用制剂有3种(0.5%或0.2%的混悬液、0.5%的软膏和0.5%的凝胶),即Lotemax®(博士伦公司),用于治疗眼部手术后的疼痛和炎症。之前的报告显示氯替泼诺眼膏的关键质量属性(交叉模量和K值)与体外药物释放率之间存在较强的对数相关性。
本研究的目的是研究cqa对体外经角膜通量的影响,以及体外药物释放和离体药物释放之间的关系。
使用球形Franz扩散池对四种具有制造差异的氯替泼诺Q1/Q2等效制剂的经角膜药物渗透进行研究。因此,我们将尝试将物理化学性质与Q1/Q2等效制剂的体外和体外药物释放之间的关联,以及体外和体外药物释放之间的关联。此外,本文还将对该软膏的体外释药机制进行研究。我们将利用三种不同的方法(Franz扩散池,带有浸没池的USP2和带有半固体适配器的USP4装置)的体外药物释放数据。使用三种常用模型(零阶动力学模型、对数模型和Higuchi模型)评估Q1/Q2等效软膏的体外药物释放动力
2.1材料
氯替泼诺(粒径:19 μm)购自美国Pure Chemistry Scientific公司。两种不同来源的白色矿脂分别购自Fisher®和Fougera®。矿物油,购自美国。氯化钠,氯化钙,十二烷基硫酸钠(SDS),购自Sigma-Aldrich,美国。碳酸氢钠购自Fisher®,美国。羟丙基-β-环糊精(HP-β-CD)购自山东滨州致远生物技术有限公司。除特别说明外,所有材料均为分析级。
2.2氯替泼诺软膏的制备
氯替泼诺软膏(药物含量:0.5% w/w)为Q1/Q2当量,按照之前报道的制备。简而言之,将白色矿脂(69.2% w/w)、API (0.5% w/w)和矿物油(30.3% w/w)的混合物(批量大小:50克)添加到塑料罐中(Unguator®)。使用三种不同的制造方法对混合物进行加工,包括:1)65℃热熔和混合,并在-20℃冰箱中立即冷却;2)在65℃热熔并在室温下混合冷却;3)室温下简单混合。混合的搅拌速度(Unguator®e/s混合器,GAKO®International GmbH)为1,450 rpm,简单混合和热熔方法的混合时间分别为6和5分钟。使用两种不同来源的白色矿脂(Fisher®,Fougera®)制备氯替泼诺眼膏制剂。4个Q1/Q2当量眼药膏。制备了具有不同制造工艺的软膏配方,并列于表1中。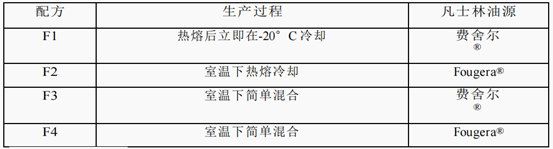
2.3HPLC 分析
采用 PerkinElmer Flexar 高效液相色谱法测定氯替泼诺的浓度,紫外检测器设置在 244 nm。流动相为乙腈-水-乙酸(65.0/34.5/0.5,v/v/v)Zorbax®Eclipse XDB-Phenyl C18 (250 × 4.6 mm, 5 μm;Agilent Technologies, USA)色谱柱,流速为 1 ml/min,柱温设置为 30℃。将 50μl 样品注入HPLC中。色谱分析采用 Chromera V3.0软件。该方法在0.02 ~ 1.00 μg/ml(R2=0.99)和0.10~5.00μg/ml(R2= 0.99)浓度范围内有良好的线性关系。2个浓度范围均具有良好的日内和日间精密度RSD(%)均< 2.0。
2.4流变学表征
使用流变仪(ARES-G2, TA Instruments, USA)和20 mm AL ST板对氯替泼诺软膏的流变特性进行表征。将约0.3 g软膏放置于下板上。将几何间隙设定为1000µm。将预处理步骤的温度设定在37℃。执行45 min时间扫描步骤以使样品完全从样品制备期间施加的剪切中恢复(在振荡应力0.1 Pa和0.1 Hz振荡频率下监测。然后进行应力扫描步骤,振荡应力从0.1变化到25 Pa,同时保持频率为0.1 Hz。在上述相同的时间扫描步骤之后,进行稳态流动步骤,剪切速率(Ẏ,1/s)从10-4 到103 s-1。以对数模式(每10年收集2点)测量样品的粘度。在测量过程中,每个点的%公差设置为5.0%。所有样本均重复测量3次。
2.5体外释放试验
采用Franz扩散池、USP2和USP4 三种释放试验方法考察氯替泼诺软膏的体外释放情况。在pH值为7.4的人工泪液(含0.67% (w/v) NaCl、0.2% (w/v) NaHCO3和0.008% (w/v)CaCl2·2H2O)中,使用0.5% SDS(w/v)在37℃进行释放测试。人工泪液使用醋酸纤维素膜(Sartorius®,平均孔径为0.45 μm),在Millipore水中保存30分钟后进行药膏加载。每隔0.25、0.5、1.0、1.5、2.0、2.5、3.0、4.0、6.0 h取一定量样品,加入新鲜介质。
2.5.1 Franz扩散池
使用容积为12 ml的垂直Franz扩散池(接触面积:1.77 cm2, PermeGear Inc.)。在添加释放介质后,将醋酸纤维素膜放置在池的受体室的顶部。然后将供体室安装在池膜上并夹紧。取150 mg软膏样品装入供体室,并在软膏顶部加入250 μl释放液,模拟眼表分泌的少量泪液。Franz扩散池的搅拌速度设定为600 rpm。在预定的时间间隔内,从受体室中抽出0.15 ml介质并补充新鲜介质。
2.5.2带有浸没池的USP2
将浸没池(表面积:4 cm2)与配备200 mlUSP2法溶出杯一起用于测定氯替泼诺软膏的体外释放特征。将50 mg软膏样品填充到浸没池的隔室中。为了防止药膏表面和膜之间的膨胀或空气夹留,使用一种薄的塑料工具将药膏表面压平。将醋酸纤维素膜置于软膏样品表面,按照制造商的说法组装池。将组装好的浸没池置于溶出杯底部且膜朝上并且随后添加预热的(37.0±0.5℃)介质(40 ml)开始测试。使用迷你桨叶将搅拌速度设定为150 rpm。在预定的时间间隔,取出1ml样品,并补充等体积新介质。
2.5.3 USP仪器4带半固体适配器
使用半固体适配器(暴露面积1.54 cm2)与USP4 进行氯替泼诺软膏的体外释放试验。将氯替强诺软膏(约330 mg)填充到适配器储存器(深度:2.6 mm)中,并用一个薄的塑料工具将储存器表面压平,以避免软膏表面和膜之间的空气夹留。将醋酸纤维素膜置于样品隔室的表面上,并按照制造商的说明组装适配器。将膜朝下的适配器装入预充有14 g 玻璃珠(直径1 mm)的流通池(直径22.6 mm)中。在37℃下以8 ml/min的流速使50 ml释放介质通过该流池循环。在预定的时间间隔,取出1 ml释放液并补充新鲜培介质。该方法是我们实验室开发的,以实现对具有制造差异的眼膏配方的区分(图1)。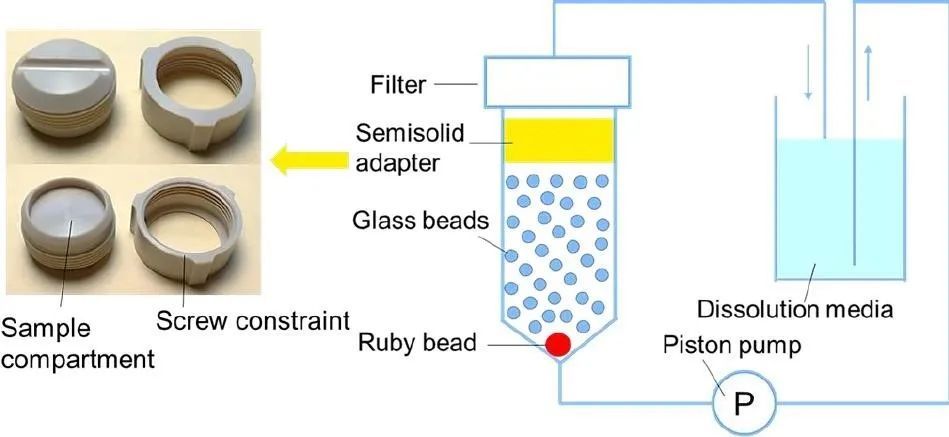
图1所示。半固体适配器的照片和USP4仪器的示意图,以及用于眼膏释放试验的半固体适配器。
2.6离体经角膜渗透性
使用带有球形关节(直径:9 mm,面积:0.64 cm2,体积:5 ml)的Franz扩散池(PermeGear公司,Hellertown, PA)(图2)来研究软膏制剂的经角膜渗透性。使用OpTMtisol-GS作为兔角膜的储存介质,Optisol-GS是用于保存角膜移植中供体角膜上皮的储存介质。将切除的兔角膜(peli -freez Biologicals, Rogers, AR)储存在OptisolTM-GS角膜储存在4°C介质(博士伦公司,NY)中。角膜在这种介质中用冰运输,并在接收后在4°C储存。所有实验均在3天内完成。在pH 7.4 的含9%(w/v)羟丙基-β-环糊精(HP-β-CD)的人工泪液中,在34℃下进行经角膜渗透性实验。向受体室中加入5 ml渗透介质,搅拌速度设定为600 rpm。将带有巩膜的兔角膜(白色部分)修剪到合适的大小,用pH值为7.4的PBS冲洗3次,然后安装到受体室的球形关节上。角膜的放置使其外部面向供体室。使用了一个钢夹收紧两个腔室受体腔内介质与角膜之间的任何气泡都被排出。供体室中加入200 μl渗透性介质使角膜平衡10 min。然后从供体腔中去除平衡介质,并通过吸收到纸巾上去除任何残留介质。将约200 mg软膏分配至供体腔中并使用分配尖端(Unguator®)使其变平。将100µl渗透介质添加至供体泪室以模拟人眼排出的泪液。观察不同浓度的含9% (w/v) HP-β-CD的pH值为7.4的人工泪液对角膜的渗透性。分别向供液室中加入1 ml浓度为8.80、17.20和35.70µg/ml的药液。用旁膜覆盖供体腔,防止水分蒸发。在预先设定的时间间隔(加样后0.5、1.0、1.5、2.0、2.5、3.0、4.0 h)抽取样本。
图2。用于经角膜渗透研究的球形关节Franz扩散池的摄影图像。
2.7 兔角膜上皮的完整性
在离体经角膜渗透实验前后检查兔角膜上皮层的完整性。将角膜组织用10%的福尔马林缓冲液(磷酸盐缓冲液)固定并包埋在石蜡块中。苏木素-伊红(he)染色观察各组大鼠角膜组织病理学改变;角膜切片组织切片采用Olympus BX51光学显微镜(Olympus America Inc.)观察。使用SPOT IMAGINGTM software(Diagnostic Instruments, Inc.,New York)进行图像采集。美国MI)。
2.8统计分析
采用Bonferroni 's检验比较各参数的均数差异。p< 0.05为显著性差异。Wilcoxon秩和检验、Mann-Whitney秩和检验用于比较体外和体外释放测试方法的区分能力。采用OriginPro 2017软件(OriginLab Corporation)进行线性回归和拟合。
3.1氯替泼诺软膏的流变学特性
根据之前的报道,氯替泼诺半固体制剂的两个关键流变学参数是交叉模量(CM)和幂律一致性指数(K值)。交叉模量是在存储模量G’等于损耗模量G”的点上获得的,当与振荡应力作图时(图3)。K值是根据公式的流变图使用Power law方程获得的。研究表明,两个关键参数(交叉模量和K值)和Q1/Q2等效软膏制剂的体外药物释放之间存在很强的对数相关性。因此,在处方筛选过程中,交叉模量和K值可用于预测Q1/Q2当量软膏制剂的体外释放率。
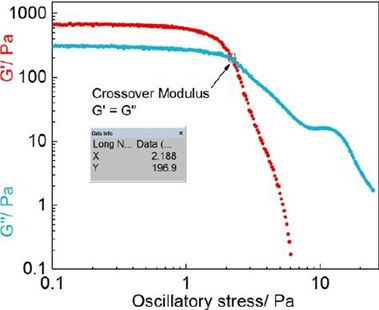
图3。代表性(F2)应力扫描剖面(对数-对数尺度),通过对振荡应力绘制G '和G "。
3.2 Q1/Q2等效软膏的体外药物释放
采用Franz扩散池法、USP2浸没池和USP4半固体适配器法对氯替泼诺软膏进行体外药物释放试验。Q1/Q2等效氯替泼诺软膏的体外释药方法的建立和评估已在之前发表。结果显示,与其他两种体外释放试验方法相比,USP4法对生产差异的Q1/Q2制剂具有最好的区分能力。不同释放方法获得的软膏制剂的体外释放率均与关键理化参数(交叉模量和K值)呈对数线性关系。
基于四种Q1/Q2等效氯替泼诺软膏的释放特征,本文使用不同模型(包括零级动力学、对数模型和Higuchi模型)来研究使用不同释放测试方法(Franz扩散池法(表2a)、具有浸没池的USP2(表2b)和具有半固体适配器的USP4(表2c))获得的氯替泼诺半固体软膏的释放动力学。Higuchi模型显示对所有获得的软膏配方和所有三种释放测试方法的最佳适合性。三种模型的拟合优度系数(R2)为:Higuchi >对数>零阶。因此,软膏的药物释放符合Higuchi模型,为扩散控制。
时间范围的选择以及时间点的个数可能会影响模型的拟合结果。采用不同的时间点和时间范围(0.25 ~ 6 h)进行模型拟合分析。如果只考虑2小时及以上的时间点,则所有三种释放测试方法的数据均由Higuchi模型变为对数模型或其他模型。对于仪器4的数据,所有4种制剂的0.25 h时间点均低于检测限。此外,药物释放最慢的制剂(F1) 0.5 h时间点也低于检出限。因此,为了公平比较,我们选择了1 -6小时的时间范围来进行模型拟合。
表2 a。氯替泼诺软膏的药物释放曲线模型拟合(Franz扩散池法)。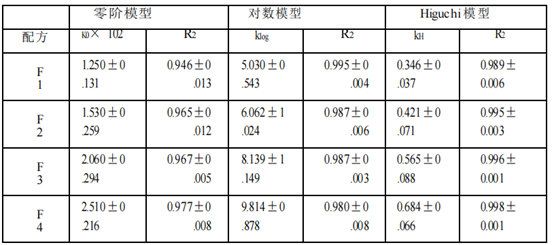
表2 b。氯替泼诺软膏的药物释放谱模型拟合(USP2浸没池法)。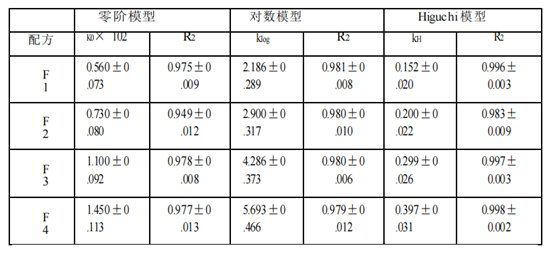
表 2 c。氯替泼诺软膏的药物释放谱模型拟合(USP 仪器 4 和半固体适配器法)。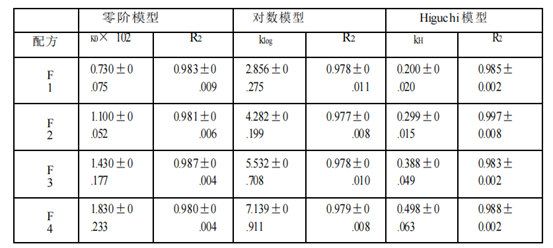
3.3 Q1/Q2 等效软膏的离体药物渗透性
3.3.1 氯替泼诺溶液的经角膜渗透性
采用兔角膜检测 9%(w/v)HP-β-CD 配制的不同浓度氯替泼诺溶液的经角膜渗透性。所有药物浓度均显示出零级渗透动力学(图 4A)和稳态经角膜通量(Jss)呈线性,与药物溶液浓度成正比(图 4B)。氯替泼诺表观渗透系数(Papp)的计算公式如下21,22: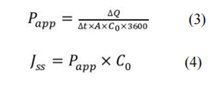
其中 ΔQ/Δt 是药物在角膜上的累积渗透量(Q)随时间的变化(t), A 是暴露的角膜表面积(本研究为 0.64 cm2 ), C0 是供体腔内药物的初始浓度,3600 是从小时到分钟的转换,Jss是稳态 ss 的经角膜通量(累积渗透曲线的斜率在图 4A 中)。氯替泼诺的经角膜渗透系数为 0.04 cm/h (1.11 × 10-5 cm/s)。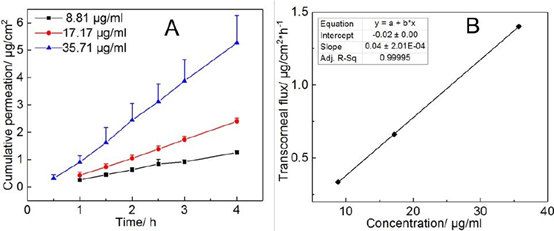
图4。A)不同浓度氯替泼诺溶液的经角膜通透性;B)通过绘制跨角膜通量与药物浓度的线性回归曲线(n=3)。
3.3.2软膏制剂的经角膜渗透性
氯替泼诺软膏的离体经角膜渗透曲线显示零级动力学(图5A)。使用零级模型拟合获得软膏的药物流量(图5B)。F1和F3的经角膜通量之间有显著差异(p< 0.05);F1和F4;以及F2和F4。比较两种不同体外释放方法与前两种方法的鉴别能力体内渗透方法,Wilcoxon秩和、Mann-Whitney秩检验按照11进行。与之前观察到的体外药物释放率相同,我们观察到制造差异的软膏制剂的经角膜通量。所有方法(三种体外释放测试方法和体外渗透法)对四种软膏配方均显示出良好的区分能力(表3)。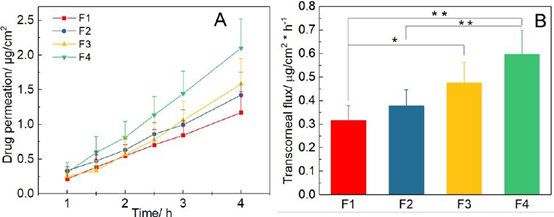
图5。A)经角膜渗透曲线;B)使用球形关节Franz扩散池获得的氯替泼诺软膏的经角膜通量(n = 6). ( p < 0.05; p < 0.01).
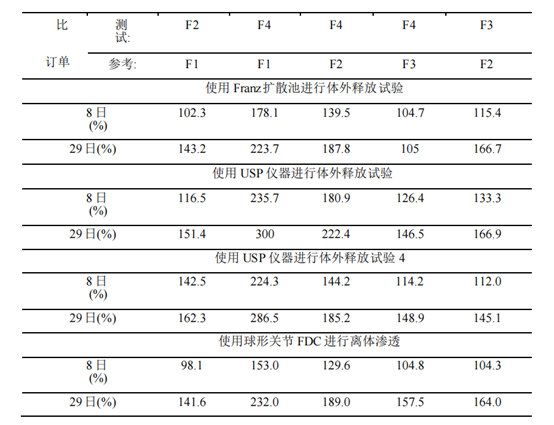
表3。用Wilcoxon秩和和曼-惠特尼(WilcoxonRank Sum/Mann-Whitney)比较3种体外释放测试方法以及体外渗透法的区分能力
3.3.3 兔角膜的完整性
本研究旨在探讨不同制造工艺对理化特性(体外药物释放)和体外经角膜通量的影响。在经角膜渗透性研究中,维持兔角膜上皮的完整性是至关重要的。因此,在实验前,以及在药物渗透研究后,上皮的完整性都被仔细检查。将角膜保存在OptisolTM-GS中,温度为4℃。在接收时(第0天)(图6A)和储存长达6天后(图6B),使用he染色检查兔角膜的完整性。角膜在至少6天内保持完整,但到第13天,上皮层不再连续,并且由于池丢失而变薄(图6C)。因此,所有角膜均在3日内使用,以确保上皮的完整性。在pH值为7.4的含0.5%(w/v)SDS的人工泪液中进行半固体眼膏的体外药物释放试验,以维持漏槽条件。然而,由于表面活性剂引起的严重去上皮,因此不能使用相同的介质进行离体渗透研究(图6D)。惠普-βcd与其他赋形剂相比,具有良好的增溶性和兔眼耐受性(即使在浓度为12.5%的水溶液中也没有毒性),是一种优良的眼科给药赋形剂。我们使用了9%(w/v)的HP-β-CD作为渗透介质,并研究了不同的作用时间。正如预期的那样,角膜在渗透介质中孵育(7小时)后保持完整(图6E)。然而,当在球形Franz扩散池中放置类似时间(6.5 h)时,上皮层(图6F)部分去上皮。通过将实验时间缩短至4 h,可以避免这种损伤(图6G)。由此推测,安装到Franz扩散池后施加在角膜上的力可能对兔角膜的完整性有显著影响。因此,在这种情况下,使用Franz扩散池进行的经角膜渗透研究的时间被限制在4小时。
氯替泼诺水溶性极低(约0.5µg/ml),在不添加增溶剂的情况下,受体舱内药物浓度远低于检测限。因此,采用HP-β-CD作为增溶剂,在保持汇条件的同时增加药物的溶解度。已有研究表明,环糊精本身不能增强药物的经角膜渗透,但它们可以通过增加房水中游离药物的量来增强局部药物向眼内的递送。在离体经角膜过程中,药物分子必须通过5个不同的角膜层。就药物渗透而言,最重要的角膜层是最外层的上皮层和最内层的基质层。其他层相对较薄,对药物的渗透没有明显的阻力。对于亲水分子来说,渗透到上皮层是限速步骤。而对于亲脂性药物分子,进入角膜基质层是限速步骤。氯替泼诺具有足够的亲脂性(logK为3.0),因此渗透到基质层是限速步骤。
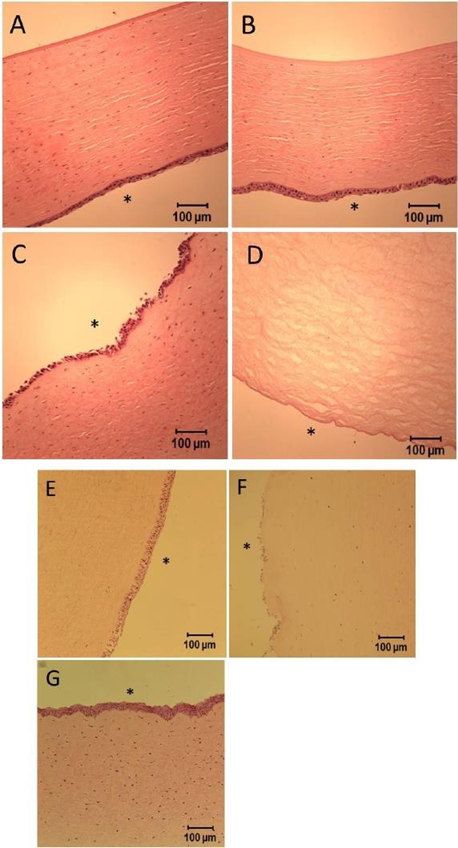
图 6。兔角膜的组织学照片:A)OptisolTM-GS储存在第0天 4℃;B)OptisolTM-GS在第6天储存于4℃中;C)在第13天储存在OptisolTM-GS中(4℃);D)在含有0.5%(w/v)SDS的pH值为7.4的人工泪液中在34℃孵育4小时;E)在含有9%(w/v)HP-β-CD的pH 7.4人工泪液中,34℃孵育7小时;F)用于经角膜渗透性研究(持续 6.5 小时);和 G)用于经角膜渗透研究(持续4小时)。代表上皮层侧(兔角膜外侧)。
3.4 眼膏释放药物的离体相关性
为了更好地了解眼膏的理化属性对体外药物流量的影响,我们使用对数模型来研究流变学参数(CM和K值)与体外药物流量之间可能的相关性。此外,使用线性模型来了解体外药物释放速率与体外经角膜药物流量之间的相关性。我们观察到所有四种软膏配方的流变学参数(CM和K值)与经角膜药物通量均有很强的对数相关性(图7A)。当比较体外药物释放谱和体外经角膜渗透谱时(图8),药物渗透速率比使用不同释放测试方法获得的体外药物释放速率要慢得多。然而,四种制剂的体外释放的等级顺序与其渗透速率是相同的。绘制四种软膏制剂的体外释放率与体外释放通量的关系图,三种释放测试方法均得到一条直线(R2> 0.98),表明四种Q1/Q2等效软膏制剂的体外-体外线性相关良好(图7B)。
使用不同的混合方法和赋形剂来源来制备四种Q1/Q2制剂。根据我们之前的研究,影响流变特性的主要有两大制造因素:1)热熔或非热熔;以及2)白色的矿脂源。与使用非热熔法(即简单混合)制备的制剂相比,使用热熔法制备的制剂显示出更高的流变性质。热熔法可使白色凡士林和矿物油紧密混合,因此,与简单混合法相比,使用热熔法制备的药膏基质更致密。我们之前的研究表明,来自Fisher®的白色矿脂比来自Fougera®的矿脂具有更高的流变特性。因此,F1显示出最高的流变学参数(交叉模量(CM)和K值),因为这一配方是用来自Fisher®的白色矿脂使用热熔法制备的。目前的研究表明,两种软膏的体外药物释放和体外药物流量是相反的与流变学参数相(图7A)。流变学参数(CM和K值)越高,体外药物释放和体外通量越低。CM和K值是用来表征软膏配方的两个不同的流变学参数。CM表征了软膏从固体状态转变为液体状态时施加在软膏上的振荡应力。CM值越高,在应力作用下从固态向液态转变的难度越大。K值表示在剪切速率为1 s-1的情况下,软膏基底的表观粘度。虽然在体外和离体药物通量实验中,软膏样品没有受到任何应力,但软膏的体外药物释放速率或离体药物通量取决于其表观黏度。这可以解释为什么与CM 比,K值与体外药物释放率和体外药物通量显示出更高程度的相关性。
在三种体外释放测试方法中,Franz扩散池法对所有四种剂型的释放率最高(图8)。这可以归因于Franz扩散池法在供体室中添加了250µl的释放介质(模拟泪液),有利于药物的释放。尽管释药速率存在差异,但对于4种Q1/Q2等效软膏,3种释药方法的释药动力学和释药等级均相同。
为了更好地理解制备工艺对眼膏的离体经角膜渗透性的影响,我们使用线性回归曲线的截距确定了四种剂型的延迟时间(图5A)。F1、F2、F3和F4的滞后时间分别为(19.4±21.9)、(15.2±11.0)、(48.3±21.9)和(33.2±14.2)分钟。热熔法制备的制剂(F1 和F2)的滞后时间显著短于非热熔法制备的制剂(F3和F4)(p < 0.05)。这可能是由于这些制剂的密度较高而导致更快的传热和温度平衡,从而允许药物在初始时间点释放。然而,一旦使用简单混合制备的制剂达到热平衡,由于这些软膏的粘度较低,药物释放得更快。与使用来自Fisher®的白色矿脂制备的制剂相比,使用来自Fougera®的白色矿脂制备的制剂显示出略短的延迟时间(即F1 vs. F2;F3 vs. F4)。这可能是由于白色的粘度较低的Fougera®石油脂。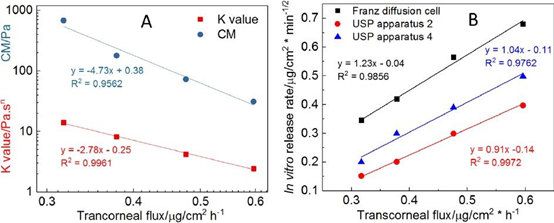
图7。A)关键参数与经角膜通量之间的线性相关(对数模式);B)体外释放率与体外经角膜通量之间的线性相关。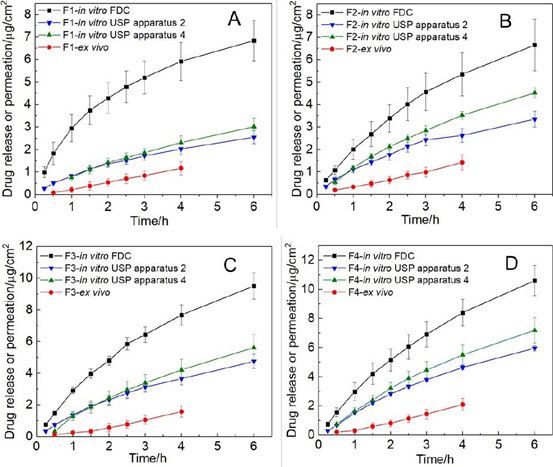
图8。四种Q1/Q2等效半固体眼膏的体外药物释放和体外经角膜渗透特征:A)剂型1;B)剂型2;C)剂型3;D)剂型4。(FDC: Franz扩散池法;USP2法:USP2 +浸没池法;USP4法;USP4采用半固体适配器法;离体:使用球形关节Franz扩散池的离体经角膜渗透)
本研究进一步证实了流变学参数(交叉模量和K值)作为表征半固体软膏配方的基准的效用。此外,这些流变学参数也可用于表征其他半固体配方,如凝胶和乳膏。流变学参数与体外和体外药物释放量之间有很强的相关性。因此,流变学参数可用于预测体外药物释放和体外药物渗透。这种相关性在以前的研究中尚未见报道。鉴于眼睛的特殊解剖结构,体内药物释放数据很难获得,并且会受到撕裂和非生产性吸收等理化因素的影响。因此,体外-体内相关性(IVIVCs)的开发对眼科制剂具有挑战性。因此,体外研究可能是比较眼用制剂包括生产差异的Q1/Q2等效制剂的一个很好的选择。离体相关性可能提示可能存在IVIVC。软膏制剂的体外药物释放是扩散控制的,因为它们的体外药物释放特征遵循Higuchi释放动力学的所有三种释放测试方法。在模型拟合过程中采用不同的时间范围,眼膏的释放动力学可能会发生变化,在选择合适的时间范围时应注意。在眼膏产品的研制过程中,应仔细检查角膜上皮的完整性,以避免任何可能的误差。
本项目的资金由美国食品药品监督管理局拨款(1U01FD005177-01)提供。本文中表达的观点不反映美国食品和药物管理局或美国卫生与公众服务部的官方政策;文中提及的任何商品名称、商业做法或组织也不意味着获得了美国政府的支持。
略 如需原文,请联系小编(15012941165)