时间:
一、流通池法概况
随着制剂技术的飞速发展,大量新剂型的诞生以及目前对于溶出度测定方法体内外相关性(IVIVC)的要求,传统的溶出度测定方法(篮法、桨法等)在进行制剂质量控制时遇到许多新的问题及难题,如微量药物制剂的测定,微球、速释等制剂的测定。流通池法作为一种新型的溶出度检测方法,除用于传统固体口服制剂的溶出度测定外,还可用于特殊剂型粉末、栓剂、颗粒剂、混悬剂、微球及药物洗脱支架(drug eluting stens, DES)等的溶出度和释放度测定,避免了已有溶出度测定方法因吸附平衡导致的溶出困难及机械搅拌的弊端,尤其适用于难溶性药物的溶出研究,能更好的模拟体内生理环境,更具有区分力。
二、流通池发展历程
流通池法,即流通池溶出度检查方法,是不同于传统溶出度测定的一种新的溶出测定方法,在美国药典、欧洲药典、日本药典、中国药典均有收载。流通池最早可以追溯到1957年,FDA专家开发了一种应用于延时释放制剂的溶出设备,此设备由储液罐、气泵、样品池组成。
20世纪70年代,SOTAX设计了第一台商业化的流通池法溶出仪。1981年,FIP(国际药学联合会)提议将流通池法作为USP1&2法的一个替代方法,用于难溶或长效释放的剂型的溶出,并且在1989年写了Pro-Pharmacopeia说明。USP和EP在1991年收录流通池法,JP在1996年收录流通池法,Chp在2020年收录了流通池法。
三、流通池法装置构成
《中国药典》2020年版0931项对第六法(流池法)做了详细说明。
装置由储存溶出介质的贮液池、用于输送溶出介质的泵、流通池和保持溶出介质温度的恒温水浴组成,接触介质与样品的部分均为不锈钢或其他惰性材料制成。应使用正文项下规定尺寸的流通池。
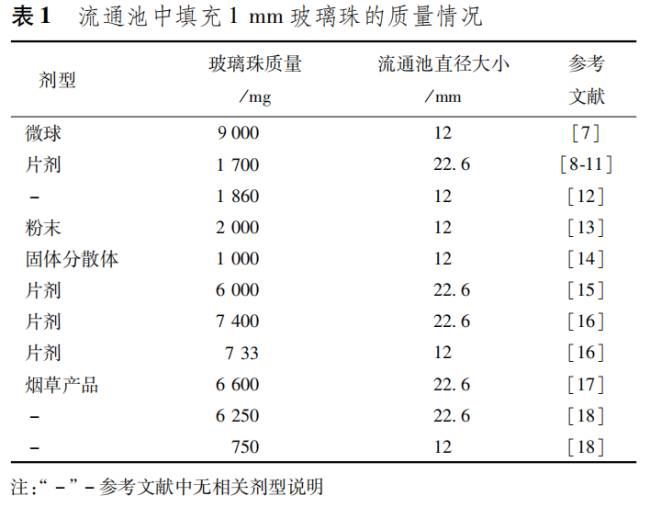
流通池,常用形状尺寸如图1和图2所示,由透明惰性材料制成,垂直安装在一个带过滤系统装置上(参见各品种项下的具体规定),以防止未溶解的颗粒从流通池顶部流出;标准流通池的内径一般为12mm/6ml 和22.6mm/14ml,流通池的锥形部分通常充填直径为1mm的玻璃珠(不同研究中填充玻璃珠的重量有所不同,具体情况见表1),在倒置的锥体下端放一直径为5mm的玻璃珠以防止样品池中的介质倒流入管路;样品支架用于放置特殊制剂,如植入片。样品池浸没在恒温水浴中,以保持温度在37℃ ± 0.5℃。
流通池用一个夹子和两个固定的O形环固定。泵应与溶出仪分开,以防止仪器受到泵产生的振动影响。泵的水平位置不得高于溶出介质的贮液池。连接管应尽量短,可采用内径为1.6mm的聚四氟乙烯惰性材料制成的法兰接头。在泵的作用下溶出介质向上流过流通池,流速通常在240-960ml/h之间。标准流速为4ml/min、8ml/min和16ml/ min。泵应能提供恒流(变化范围为规定流速的±5%),流速曲线应为正弦曲线,脉动频率为120±10冲/分,也可使用无脉冲泵。采用流池法进行溶出度检查的方法,应规定流速与脉冲频率。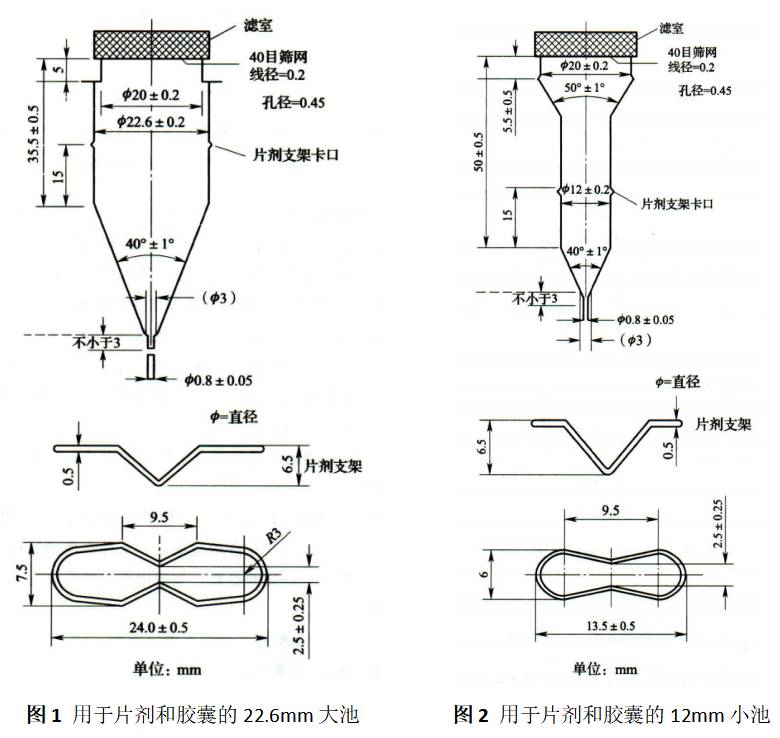
四、流池法分类
4.1 闭合式系统
闭合式系统,是一种循环式流通池法(如图3),将样品置于特别设计的流通池中的样品架上,溶剂预先加热至37℃,由恒流泵泵入。溶剂经过装有恒温装置的水浴,进入流通池的下端,与样品接触,并由流通池的上端过滤后流出,其溶出曲线如图4。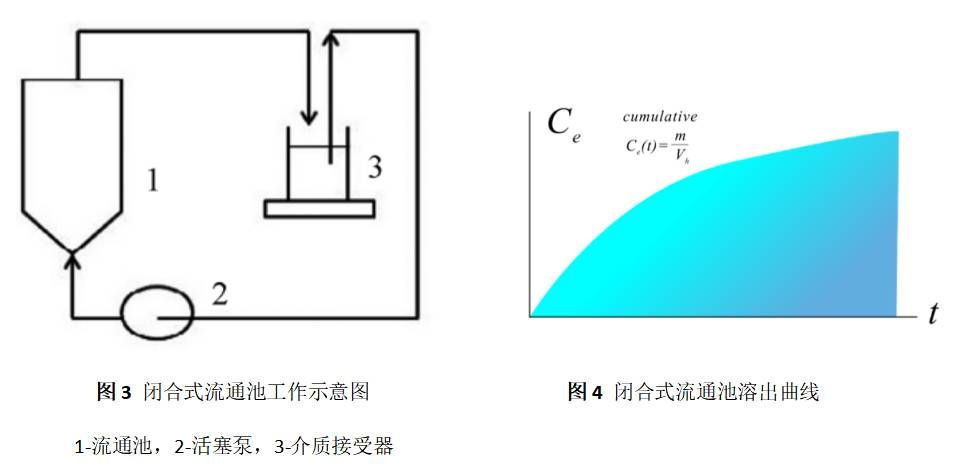
4.2 开放式系统
开放式系统,是一种开放式流通池法(如图5),与闭合式系统的主要区别是溶出介质通过流通池后不再返回,可自动改变溶出介质种类或pH,用于模拟胃肠道pH变化。溶出介质在通过流通池后使用自动取样装置按时间点进行取样,大量新鲜溶出介质不断流经被测样品,让固体随时与新鲜介质接触,逐渐溶解到最后溶尽为止,溶出部分会及时被带离流通池,始终保持漏槽条件要求,其溶出曲线如图6。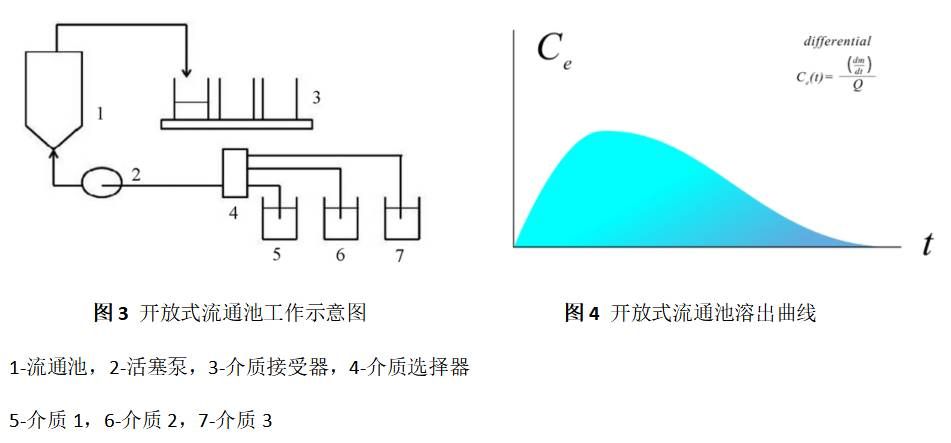
五、流通池法特点
5.1 流通池法优点
①更容易维持漏槽条件,开环模式更适用于难溶性药物的溶出度测定;②实验过程中可以随时改变溶出介质组成、pH等条件;③流通池上端安装有过滤装置,可以避免不需要的过滤离心等步骤,根据不同制剂的粒径要求可以采用不同类型或不同粒径大小的过滤器;④流通池可与其他分析仪器连接实现在线分析,有研究表明,桨法与其他在线分析仪器连接时可能会发生探针堵塞等情况,而使用流通池法通过过滤装置可以将未溶解的药物颗粒留在流通池从而避免探针堵塞等问题,方法重现性良好。通常将流通池法与紫外分光光度法(UV)联用进行体外释放研究,而Rudd等将流通池与在线HNMP检测联用进行体外释放行为研究,可区分复杂晶体纳米混悬剂环境中单个成分的存在。Yoshida等使用粒子图像测速系统(PIV)连续采集图像获得流体的瞬时速度矢量以评价具有和不具有蠕动泵的流通池中流体流动的特性;⑤具有良好的体内外相关性(IVIVC):IVIVC是一种预测性数学模型,描述了体外药物释放与体内血浆药物浓度或药物吸收速率之间的关系。其中,A级体内外相关性被认为是体外与体内数据相关关系的最有力证明,也是唯一被监管机构认可的、可用于替代生物等效性研究(BE)的相关性等级。已有研究证明,流通池法用于纳曲酮或利培酮聚合物微球的溶出度测定具有体内外相关性;⑥设计不同类型的流通池,如粉末和颗粒流通池、亲酯剂型制剂流通池、混悬剂流通池等,可以更好地满足不同剂型质量控制的需要;⑦泵的类型可以改变,流速的控制依赖于泵,所以泵的类型也是影响方法稳定性的重要因素。Yoshida等研究两个脉冲泵(半正弦,全正弦)和 1个非脉冲泵的流量变化对USP标准片剂溶出度的影响,发现由不同类型的泵提供的流体流量变化产生不同的溶出曲线。满足USP要求的由泵脉冲引起的瞬时流体流量变化是影响流通池法系统中片剂溶出度的1个重要因素。不同的泵和过滤器类型见表2。
5.2 流通池法缺点
虽然流通池的优点有很多,但应用流池法模拟难溶性药物体内溶出的研究还很少且仍缺乏对方法的系统研究。另外流池法还存在一定的缺点,例如:①研究仪器操作较为繁琐,在使用过程中应周期性地监控关键的实验参数,如溶出介质的体积与温度、溶出介质的流速等;②存在仪器昂贵,成本较高等问题,应根据实验具体情况综合考虑方法的选择。
六、流通池法的应用
6.1 流通池法在片剂及胶囊剂中的应用
口服固体药物片剂和胶囊剂的溶出研究多采用桨法等传统溶出方法,但在溶出时不易更换溶出介质且溶出介质体积选择受限。Van der Vossen等采用流通池法及模拟新生儿和婴幼儿禁食状态的溶出介质对儿童用药硝苯地平和氯羟去甲安定片剂及胶囊剂进行溶出试验,为儿童用药药动学研究提供了体外试验依据。目前,国外关于流通池法片剂和胶囊剂的体外实验研究相对较多。李辉等采用桨法和流通池法两种溶出方法考察了尼莫地平片实验制剂和参比制剂体外溶出行为的一致性,得到了不同实验结果,而流通池法更接近体内实际情况,具有更好的区分力,理论上能为BE研究提供更有力的数据支持。这为片剂溶出度研究和国内流通池法的应用提供了新的研究思路。
6.2 流通池法在纳米混悬剂中的应用
纳米混悬剂是1种纯药物亚微米胶体分散系统,通常具有较高的载药量,良好的水分散性和物理稳定性等特点。纳米混悬剂能够有效解决药物溶解性差和载药量低等问题,因此得到广泛应用。Forrest等评估了包括桨法(USP2法)、透析、反向透析囊法,以及流通池法在内的几种不同的体外释放方法在纳米混悬制剂筛选和工艺开发中的应用。结果表明,流通池法优于USP2法及透析和反透析囊法。美国药典USP2法和反向透析囊法由于不具有代表性的流体动力学特性,对纳米混悬剂的黏度差异不敏感。由于水溶性差的化合物堵塞了膜孔,因此不适合使用透析囊法。流通池法能更好的模拟体内流体力学且更易维持漏槽条件,是唯一能够根据组成、加工参数、粒度分布(PSD)和黏度区分纳米悬浮剂的释放方法。研究者们还研究了纳米混悬剂以储库形式或层状形式放置于流通池时对药物释放的影响,层状放置时药物溶出速度更快一些。也有研究在溶出介质流动前将混悬剂置于流通池的玻璃珠顶端或将药物纳米混悬剂放入透析袋中然后置于流通池中进行体外释放实验。纳米混悬剂样品的具体放入方式灵活多变而方法的重现性有待于进一步的研究和优化。
6.3 流通池法在微球制剂中的应用
微球是1种通过不同的给药方式产生长效治疗作用的控释制剂,其可以在数周或数月内长时间释放药物以达到缓释效果。流通池法可以有效地用于研究蛋白质负载的微球以及小分子负载的微球,且方法重现性良好。有研究比较了流通池法和样品分离法用于负载蛋白质(牛血清白蛋白)的微球的体外测试,虽然蛋白质在玻璃珠疏水表面上的吸附会导致蛋白质总体累积释放百分比的异常降低,但可以通过使用合适的表面活性剂(例如十二烷基硫酸钠)来避免这种情况。Tipnis等使用流通池法进行布地奈德聚(乳酸-羟基乙酸)共聚物(PLGA)微球的体外释放研究并优化了关键仪器参数和介质参数,方法的优化可以为其他微球制剂的体外释放条件提供参考。药物从聚合物微球的释放与聚合物降解、药物扩散、聚合物的性质,以及药物聚合物相互作用有关。Kohno等采用流通池法研究了PLGA相对分子质量差异对利培酮微球释放的影响。结果表明,聚合物的玻璃化转变温度及微球的孔隙率和粒径比聚合物的相对分子质量的影响更大。通过优化实验过程中的仪器参数和介质参数流通池法法有望在微球制剂中得到更广泛的应用。
6.4 流通池法在口腔膜剂中的应用
Speer等对流通池法进行改进,将流通池与3D打印的膜剂支架结合(流通池法+FH3D法),使膜剂可以在不同的流速和不同的介质中进行释放,从而模拟药物在胃肠道的转运。引入3D打印膜剂支架后,可以在实验过程中使膜剂保持在恒定位置,从而减小误差,在研究膜剂释放时更具有区分力。另外,流通池法使用的介质体积较小,可以很好的模拟人口腔中唾液的体积,从而更好地模拟膜剂在口腔的释放,样品支架的使用将样品室内的有效容积减少到大约3ml,这与生理唾液的体积更好地吻合。但仍需要进行体内研究以探究流通池法+FH3D法是否能够预测口腔膜剂的体内性能。有研究表明,流通池法+FH3D法导致双层膜剂(ODFDL)的药物释放速率降低,故该方法可用于检查膜剂保护层的完整性,进行单向药物释放研究。以上流通池法与3D打印技术的联用使方法更具有区分力,可以更好的模拟体内生理条件。
6.5 在栓剂中的应用
栓剂是指原料药与适宜基质等制成供腔道给药的固体制剂。Hori等使用转篮法、桨法、透析袋法(DT)和流通池法等4种溶出方法研究了含有对乙酰氨基酚(AAP)的亲脂性栓剂的释放特性,发现使用流通池时最终AAP的最大溶出量(Q)约为100.4%~100.8%,平均溶出时间(MDT)约为70.9~90.3min,溶出效率(DE)约为74.7% ~80.3%,使用转篮法时,AAP释放效果不佳。透析袋法与流通池法结果相似,但膜渗透成为限速步骤,隐藏了释放动力学,因此,不推荐使用该法。相比于桨法,流通池法对水动力学强度的依赖性较小,且数据可重复性和一致性好。韩煦等采用流通池法在不同流速和不同溶出介质下研究消糜栓剂中不同指标成分的溶出度,发现流通池法不同参数设定影响消糜栓剂中指标成分的溶出度测定。流通池法可作为栓剂溶出度测试的有效方法。
6.6 流通池法在DES中的应用
尽管第1个DES在2002年获得了监管部门的批准,但关于其体内和体外的释放行为研究有限。此外,体内研究通常集中于血液中的药物水平而不是血管壁中的药物浓度。血管壁是抗增殖剂的目标部位,只能在去除支架后的动物模型中确定药物的组织浓度,而体外研究可帮助研究DES的体内释放行为。目前,用于研究DES的体外释放行为的方法主要有溶出介质体积较小的孵育法、往复桶法和流通池法。有研究者考虑到药物在组织中的分布,引入水凝胶作为模拟植入支架的组织。将流通池法进行改进得到血管模拟流通池,从而研究氨苯喋呤从药物支架中的释放,发现单独使用流通池法可能会高估药物的释放,血管模拟流通池法可作为更具有生物相关性的溶出度测定方法。使用血管模拟流通池法时,药物的释放情况与水凝胶基质的组成有关。这为流通池法的进一步改进以用于特殊剂型提供了参考。
七、展望
随着大量新剂型的涌现,传统的溶出方法存在一定的局限性,如搅拌不充分、溶出介质的体积选择受限,以及不能很好地模拟体内环境等缺点。流通池法可以对传统溶出方法进行弥补,样品支架的设计解决了样品漂浮问题,介质体积可以大于1000ml或小于400ml,可更好地模拟儿童胃肠道环境,适用于片剂、胶囊剂、微球、纳米混悬剂、栓剂、膜剂及DES等的溶出度测定。流通池法还可以随时改变溶出介质,但该方面的研究较少。目前,华溶已经成功开发出新一代的国产流通池,可自动改变溶出介质种类或pH,用于模拟胃肠道pH变化;并可根据不同剂型,选择从2到32ml/min的不同流速。当然随着制药研发技术的不断提升,国内关于优化仪器参数和关键的实验参数的研究还需要不断提高,走向国际化。
参考文献:
《流通池法在药物制剂中的应用进展》